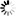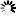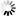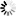Kotimaisia valtapuulajeja uhkaavat vieraslajihyönteiset – pronssijalosoukko, siperianmäntykehrääjä ja taigamonikirjaaja
Koivula M., Koivula H., Melin M., Nuorteva H., Vihervuori L., Ylioja T., Viiri H., Velmala S. (2022). Kotimaisia valtapuulajeja uhkaavat vieraslajihyönteiset – pronssijalosoukko, siperianmäntykehrääjä ja taigamonikirjaaja. Metsätieteen aikakauskirja vuosikerta 2022 artikkeli 10729. https://doi.org/10.14214/ma.10729
Tiivistelmä
Ilmastonmuutos edesauttaa useiden hyönteislajien leviämistä alueille, joiden ympäristöolosuhteet eivät ole aiemmin olleet niille tarpeeksi suotuisat. Tällaisia luontaisesti, omin voimin levinneitä tulokaslajeja tavataan Suomessakin. Suurin osa niistä on harmittomia, mutta osa on haitallisia maa- ja metsätaloudelle. Tulokaslajeja potentiaalisesti vaarallisempi ryhmä ovat vieraslajit; ihmisten ja kansainvälisen kaupan mukana leviävät lajit. Uudella alueella vieraslajilta puuttuvat juuri siihen erikoistuneet luontaiset viholliset, kuten loiset ja saalistajat, sekä monet muut kannan kasvua rajoittavat tekijät. Lisäksi uuden alueen eliölajeilla ei välttämättä ole vastuskykyä tai puolustusmekanismeja uutta tuholaista kohtaan. Tällöin vieraslaji voi aiheuttaa merkittävää tuhoa, ja tällaisia esimerkkejä on maailmalta useita. Tässä artikkelissa esittelemme kolme Suomen metsätalouden kannalta mahdollisesti erittäin haitallista vieraslajia: Pohjois-Amerikasta kotoisin oleva koivun tuholainen pronssijalosoukko (Agrilus anxius LeConte), mäntyjä ja lehtikuusia uhkaava kehrääjälaji siperianmäntykehrääjä (Dendrolimus sibiricus Chetverikov) sekä useille puulajeille jo sopeutunut, Venäjällä leviävä kaarnakuoriainen taigamonikirjaaja (Polygraphus proximus Blandford). Käymme näiden lajien osalta läpi niiden biologian ja ekologian sisältäen isäntäpuut, loiset ja saalistajat, tuhohistorian sekä kotiseudullaan että vieraslajina, näiden hyönteisten todennäköiset leviämisreitit Suomeen sekä vaikutukset, jos lajit tänne leviäisivät.
Avainsanat
Agrilus anxius;
Dendrolimus sibiricus;
Dendrolimus superans;
karanteenituhooja;
Polygraphus proximus;
tulokaslaji;
vieraslaji
-
Koivula,
Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki
Sähköposti
matti.koivula@luke.fi

- Koivula, CSC – Tieteen Tietotekniikan Keskus, Espoo Sähköposti hanna.koivula@csc.fi
- Melin, Luonnonvarakeskus (Luke), Luonnonvarat, Joensuu Sähköposti markus.melin@luke.fi
- Nuorteva, Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki Sähköposti heikki.nuorteva@luke.fi
- Vihervuori, Ruokavirasto, Kasvinterveysyksikkö, Helsinki Sähköposti liisa.vihervuori@ruokavirasto.fi
- Ylioja, Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki Sähköposti tiina.ylioja@luke.fi
- Viiri, UPM Metsä, Tampere Sähköposti heli.viiri@upm.com
- Velmala, Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki Sähköposti sannakajsa.velmala@luke.fi
Vastaanotettu 16.3.2022 Hyväksytty 15.11.2022 Julkaistu 23.11.2022
Katselukerrat 111699
Saatavilla https://doi.org/10.14214/ma.10729 | Lataa PDF

 |
1 Johdanto
Metsätuholla tarkoitetaan metsänomistajalle tai metsätalouden toimijalle koituvaa tappiota puuston kasvun hidastumisen, puutavaran laadun alenemisen tai puiden kuolleisuuden kasvun vuoksi. Hyönteisissä on lajeja, jotka tietyissä olosuhteissa voivat aiheuttaa tällaisia vahinkoja. Kotimaisesta lajistosta merkittävin on kirjanpainaja (Ips typographus L.), joka hyötyy pitkistä kuumuus- ja kuivuusjaksoista ja tappaa niiden takia heikentyneitä, järeitä metsäkuusia (Picea abies (L.) H. Karst.) (esim. Marini ym. 2017; Uotila ym. 2020; Nardi ym. 2022). Ilmaston muuttuminen ja ihmistoiminta vaikuttavat tuhoja aiheuttaviin massaesiintymiin niin Suomessa kuin maamme ulkopuolellakin. Ilmastonmuutos voi näkyä esimerkiksi lajien levinneisyysalueiden muutoksina, levittäytyvien lajien menestymisenä uusilla seuduilla sekä lajien välisten vuorovaikutuksien muutoksina. Esimerkiksi Suomessa havununna (Lymantria monacha L.) on levittäytymässä pohjoiseen (Fält-Nardmann ym. 2018; Elfving 2020) ja pitkäkestoinen kuivuus ja leudot talvet ovat käynnistäneet massaesiintymiä vuoristonilurilla (Dendroctonus ponderosae Hopkins) Kanadassa (Millar ja Stephenson 2015), mäntykehrääjällä (Dendrolimus pini L.) Saksassa (Haynes ym. 2014) sekä taigamonikirjaajalla (Polygraphus proximus Blandford) ja siperianmäntykehrääjällä (Dendrolimus sibiricus Chetverikov; joissakin yhteyksissä katsottu myös lajin D. superans Butler alalajiksi) Venäjän Siperiassa (Kharuk ym. 2016, 2018).
Edellä luetellut massaesiintymät ovat pääasiassa seurausta lajien levittäytymisestä omin avuin uusille seuduille ilmaston, metsärakenteiden ja maankäytön salliessa. Tällöin puhutaan tulokaslajeista. Toisaalta uusille alueille voi saapua vieraslajeja: ne saapuvat nimenomaan ihmisen auttamana ja voivat näin siirtyä jopa mantereiden välillä. Vieraslajit voivat olla uhka niin taloudelle kuin kotoperäiselle lajistollekin, koska uudella seudulla ei välttämättä ole tulokkaan hyödyntämiseen erikoistuneita bakteereja, viruksia, loisia, saalistajia tai voimakkaita kilpailijoita, eikä uuden alueen isäntäpuilla välttämättä ole tehokkaita puolustuskeinoja (Sakai ym. 2001; David ym. 2017; Seidl ym. 2018). Osa vieraslajeista luokitellaan asetuksen (EU) 2019/2072 perusteella nk. karanteenituhoojiksi. Näitä lajeja ei saa esiintyä kasvintuotannossa, myytävissä kasveissa eikä luonnossa EU:n alueella, ja niiden ilmaantumista on jatkuvasti seurattava. Jos jokin näistä lajeista havaitaan EU:n alueella, sen hävittämiseksi ryhdytään toimiin lainsäädännön, mahdollisen valmiussuunnitelman sekä Euroopan elintarviketurvallisuusviranomaisen (EFSA) tietokorttien ja ohjeiden mukaisesti. Metsätalouden karanteenilajeja ovat mm. aasianrunkojäärä (Anoplophora glabripennis Motschulsky), saarnenjalosoukko (Agrilus planipennis Fairmaire), pronssijalosoukko (Agrilus anxius LeConte), siperianmäntykehrääjä, taigamonikirjaaja sekä mäntyankeroinen (Bursaphelenchus xylophilus Steiner & Bührer) ja sen vektorina toimivat, Euroopan ulkopuolelta peräisin olevat Monochamus Dejean -suvun tukkijäärät. Suomen luonnossa näistä on tähän mennessä havaittu ainoastaan aasianrunkojäärä, jonka esiintymän Ruokavirasto on hävittänyt täytäntöönpanopäätöksen (EU) 2015/893 nojalla. Mäntyankeroisia ei ole Suomessa tavattu elävistä puista, mutta niitä on tavattu kymmeniä kertoja Suomeen tuodusta puisesta pakkausmateriaalista ja hakkeesta. Ruokavirasto on laatinut lukuisille metsiä uhkaaville vieraslajeille riskiarviot koskien niiden saapumistodennäköisyyksiä ja oletettavia taloudellisia vaikutuksia.
Yleisesti hyönteisten massaesiintymien syntyyn vaikuttavat kiihdyttävästi edeltävien kesien ja alkukesän lämpimyys ja kuivuus sekä loisten alhainen kannantiheys (Pavlov ym. 2018). Toisaalta taudinaiheuttajat altistavat hyönteistuhoille: esimerkiksi mesisieni Armillaria (Fr.) Staude näyttää olleen joidenkin vuoristonilurin massaesiintymien taustalla läntisessä Pohjois-Amerikassa (Tkacz ja Schmitz 1985) sekä kirjanpainajaesiintymien taustalla Slovakiassa (Jakuš 1998, 2001). Massaesiintymät sammuvat sopivien isäntäpuiden harventuessa (Kharuk ym. 2018), mutta oletettavasti myös saalistuksella, loisilla ja taudeilla on merkityksensä. Vieraslajien dynamiikka on kuitenkin erilainen, koska uudesta ympäristöstä usein puuttuvat tehokkaat luontaiset viholliset ja koska puilta saattaa puuttua vastustusmekanismeja ko. lajia vastaan (Sakai ym. 2001; David ym. 2017; Seidl ym. 2018). Lisäksi, vaikka vieraslaji kykenisi perustamaan elinkykyisen populaation uudelle alueelle, kaikki sen seuralaislajit eivät välttämättä tähän kykene. Esimerkiksi taigamonikirjaajan sieniseuralaisten monimuotoisuuden on havaittu laskevan lähtöalueilta länteen tultaessa, mikä osuu yksiin kuoriaisen geneettisen vaihtelun vähenemisen kanssa (Kononov ym. 2016). Näin ollen vieraslajien tuhoriskiä Suomessa tulee tarkastella eri tavoin kuin tulokaslajien tai meillä jo elävien lajien kohdalla. Suomen kohdalla asia on kuitenkin vakava myös sen takia, että metsäalamme nojaa niin vahvasti vain kolmeen pääpuulajiin – metsämäntyyn (Pinus sylvestris L.), metsäkuuseen ja koivuihin, jolloin näihin erikoistuneilla vieraslajeilla voi olla arvaamattoman suuria yhteiskunnallisia vaikutuksia. Vieraslajeja voi saapua Suomeen esimerkiksi sahatavaran, hakkeen, puisen pakkausmateriaalin tai polttopuun mukana. Syynä voisi olla puhdas vahinko esimerkiksi puutavaran käsittelyssä (esimerkiksi puulavojen kuumennuskäsittelyn laiterikko) tai varastoinnissa (hyönteisiä voi päästä iskeytymään varastoituun puutavaraan), mutta myös huolimaton käsittely ja puutteellinen valvonta puutavaran lähtömaassa. Puutavaran lämpökäsittelymerkintöjä on myös verraten helppo väärentää. Venäjällä eräät puustotuholaiset leviävät tehokkaasti ihmisten ja rautatieliikenteen mukana Aasiasta Eurooppaan (esim. Kerchev 2014; Selikhovkin ym. 2017). Lajit kulkeutuvat myös puuntaimien ja koristekasvien mukana. Mitä useammalla tavalla laji kykenee hyödyntämään ihmisten ja tavaran liikkumista, sitä tehokkaammin se leviää uusille alueille.
Tässä katsausartikkelissa tarkastelemme kolmea hyönteislajia, joiden on mahdollista saapua ihmistoiminnan seurauksena Euroopan Unionin alueelle ja Suomeen – pronssijalosoukkoa, siperianmäntykehrääjää ja taigamonikirjaajaa (Kuva 1). Näiden lisäksi lainsäädännössä on listattu muitakin karanteenituhoojia, mutta tässä käsiteltävät lajit ovat suomalaisen elinkeinorakenteen kannalta keskeisiä, koska ne kykenevät hyödyntämään metsäkuusta, metsämäntyä tai raudus- ja hieskoivua (Betula pendula Roth ja B. pubescens Ehrh.). Keräsimme katsausta varten 15.7.2020 Web of Science -tietokannasta kyseisiä lajeja tarkastelevat tutkimukset, käyttämällä haussa pelkästään kunkin lajin tieteellistä nimeä. Löysimme näin 27 vertaisarvioitua julkaisua pronssijalosoukosta, 45 siperianmäntykehrääjästä ja 25 taigamonikirjaajasta. Täydensimme hakua samasta tietokannasta 15.1.2022 saadaksemme uusimmat tutkimukset mukaan, etsimme lisälähteitä löytämiemme julkaisujen kirjallisuusluetteloista ja haimme lajeja käsitteleviä raportteja Google Scholaria käyttäen. Rajasimme löytämistämme julkaisuista mukaan ne, jotka tarkastelivat lajien biologiaa sekä niiden metsille aiheuttamia riskejä ja torjuntaa. Katsaukseen päätyi lopulta 14 tutkimusartikkelia pronssijalosoukosta, 22 siperianmäntykehrääjästä ja 26 taigamonikirjaajasta; lisäksi sisällytimme 47 muuta tutkimusjulkaisua, kuusi katsausartikkelia ja yhdeksän raporttia. Kuvailemme kunkin lajin biologiaa niiden kotiseudulla, niiden leviämishistoriaa sellaisilla seuduilla, joille ne ovat levittäytyneet olosuhteiden muuttuessa itse tai ihmisen tuomana, sekä niiden aiheuttamia puustotuhoja ja tuhojen torjuntakeinoja (Taulukko 1). Lopuksi pohdimme näiden lajien torjuntakeinoja, mahdollisia vaikutuksia Suomen kannalta sekä tulevia tutkimustarpeita.

Kuva 1. Saarnenjalosoukko ja ulostuloreikiä koivulla (Steven Katovich, Bugwood.org kuva nro 1398032, ylh.); siperianmäntykehrääjä (Natalia Kirichenko, Bugwood.org kuva nro 5174047, kesk.); taigamonikirjaajan syömäkuvioita (kuva nro 9b julkaisussa Musolin ym. 2022, alh.). Bugwood.org lupa nro 187214 (ylh. ja kesk.) ja CC-BY-4.0 -lisenssi (alh.).
| Taulukko 1. Kolmen puustotuhoja aiheuttavan, Suomeen mahdollisesti leviävän hyönteislajin ekologisia piirteitä sekä arvioita todennäköisimmistä leviämisreiteistä ja torjuntakeinoista. | |||
| Piirre | Pronssijalosoukko | Siperianmäntykehrääjä | Taigamonikirjaaja |
| Alkuperäalue | Eteläboreaalinen Pohjois-Amerikka | Itäinen Siperia | Itäinen Siperia, Japani, Korean niemimaa |
| Isäntäpuut | Koivulajit | Eri sukujen havupuut | Pihdat |
| Elinkierto (vuosia) | 1–2 | 2–3 (5) | 2 |
| Tunnettuja vihollisia | Loispistiäisiä | Loispistiäisiä, sienitauteja | Kaksisiipisiä, loispistiäisiä, kovakuoriaisia, sienitauteja |
| Vaikutukset eurooppalaisiin isäntäpuulajeihin | Korkea kuolleisuus euraasialaisilla koivuilla | Lehtikuusten ja pihtojen kuolleisuus; laboratoriossa lisääntynyt metsämännyllä ja metsäkuusella | Korkea siperianpihdan kuolleisuus; satunnaisesti löydetty metsäkuuselta ja havaittu lisääntyvän metsämännyllä; laboratoriossa lisääntynyt lehtikuusilla |
| Puustotuhoriskiin vaikuttavia tekijöitä | Riski suuri Euraasiassa koivujen yleisyydestä ja laajasta levinneisyydestä johtuen | Riski kotimaisille puulajeille matala; edellyttää hyönteisen sopeutumista metsäkuusen ja/tai metsämännyn hyödyntämiseen | Riski kotimaisille puulajeille matala; edellyttää hyönteisen sopeutumista metsäkuusen, metsämännyn ja/tai lehtikuusten hyödyntämiseen |
| Todennäköisin saapuminen Suomeen | Energia- ja koristepuun tuonti | Luontainen levittäytyminen; taimi- ja puutavarakuljetukset | Havupuutavaran tuonti |
| Torjuntakeinoja maailmalla | Biologinen: loispistiäiset Kemiallinen: atsadiraktiini, emamektiinibentsoaatti | Biologinen: loispistiäiset, Beauveria bassiana, Bacillus thuringiensis Kemiallinen: pyretroidit, jasmonihappo | Biologinen: taudinaiheuttajasienet, etenkin Beauveria bassiana |
2 Tarkasteltavien lajien biologia alkuperäisseuduillaan
2.1 Alkuperäinen levinneisyys ja isäntäpuulajit
Pronssijalosoukko kuuluu jalokuoriaisiin, joita maailmalta tunnetaan noin 15 000 lajia (Bellamy 2012, 2014). Se on pohjoisamerikkalainen lehtipuuvaltaisten metsien laji, joka on tulokaslajina levittäytynyt eteläisiin ja läntisiin Yhdysvaltoihin osin siksi, että eri koivulajeja käytetään siellä yleisesti puisto- ja koristepuina (Muilenburg ja Herms 2012). Kuoriaisen kotoperäisen levinneisyysalueen isäntäpuulajit ovat paperi-, poppeli-, sokeri-, kelta- ja jokikoivu (vastaavasti Betula papyrifera Marshall, B. populifolia Marshall, B. lenta L., B. alleghaniensis Britton ja B. occidentalis Hook.). Lajilla on ajoittaisia massaesiintymävuosia näillä koivulajeilla (Muilenburg ja Herms 2012), joita se voi myös tappaa kuumina ja kuivina kesinä (Jones ym. 1993). Infektoidun puun latvaoksat alkavat kuolla ensimmäisenä, tuho etenee alaspäin ja puu voi vielä elää useita vuosia. Enintään neljännes koivuyksilöistä kuolee 20 vuodessa, mutta kuolleisuus vaihtelee puulajeittain: esimerkiksi poppeli- ja jokikoivun kuolleisuus on vähäistä (Nielsen ym. 2011). Eri koivulajien väliset kelpaavuuserot johtunevat puulajien ja myös paikallisten puupopulaatioiden eroista puolustusmekanismeissa ja -kemikaaleissa, etenkin puolustusfenoli- ja tanniiniyhdisteissä (Muilenburg ym. 2011, 2013; Muilenburg ja Herms 2012). Toukkia tavataan eri korkeuksilta puista (Loerch ja Cameron 1984), mutta ne aloittavat rungosta siirtyen vasta myöhemmin oksiin (Ball ja Simmons 1980). Toukat syövät pääasiassa versojen tai oksien nilaa, ja jos toukkia on paljon, ne vaikuttavat kaulaamiseen verrattavalla tavalla esimerkiksi oksaan, mikä estää ravinteiden, hiilihydraattien ja nesteiden virtauksen (Anderson 1944; Barter 1957). Oksan tai puun kuollessa se säilyy parisen vuotta pronssijalosoukolle kelvollisena: Rutledge (2020) keräsi yksilöitä eri vuosina kaulatuilta koivuilta ja havaitsi, että kahden ensimmäisen kesän saaliit eivät eronneet toisistaan.
Siperianmäntykehrääjä on levittäytynyt laajalti Siperian havumetsiin, Koillis-Kiinaan, Pohjois-Mongoliaan ja Pohjois-Koreaan (Kirichenko ym. 2009). Se on levittäytynyt Uralin länsipuolelle ilmeisesti 1900-luvun alkupuolella (Peterson 1904), ja nykyisin sitä tavataan yleisesti Euroopan puoleisen Venäjän keskiosissa (Gninenko 2000). Massaesiintymät ovat aiheuttaneet havupuiden kuolemia Itä-Siperiassa. Näiden tuhojen merkitystä on vaikea arvioida epidemiapinta-alojen valossa, mutta laji aiheutti esimerkiksi lehtikuusikuolemia yli miljoonalla hehtaarilla Irkutskissa vuosina 1870–1952, 1,5 miljoonalla hehtaarilla Tšitan alueella vuosina 1931–1941 ja 2,5 miljoonalla hehtaarilla Ketin ja Chulymin alueella 1951–1957 (Kharuk ja Antamoshkina 2017; CABI 2020). Siperianmäntykehrääjän toukat (aikuiset eivät syö mitään) käyttävät ravintonaan useiden havupuulajien, etupäässä mäntyjen, neulasia (Kharuk ym. 2007; Kirichenko ym. 2009). Luonnossa lajin on havaittu hyödyntävän useita lajeja pihtojen, lehtikuusten, kuusten ja mäntyjen havupuusuvuista (Kharuk ym. 2004, 2007; CABI 2020). Isäntäpuu vaihtelee alueittain, mutta toukille kelpaavat mainiosti esimerkiksi siperian- ja koreansembran (Pinus sibirica Du Tour ja P. koraiensis Siebold ja Zucc.) sekä siperian- ja dahurianlehtikuusen neulaset (Larix sibirica Ledeb. ja L. gmelinii (Rupr) Kuzen). Eversmann (1844) raportoi lajista Uralilla, ja Gninenko ja Orlinskiy (2002) kertoivat lajia tavatun jo pitkään Uralin ja Moskovan välillä.
Taigamonikirjaajan alkuperäistä levinneisyysaluetta ovat Habarovskin ja Primorskin aluepiirit sekä Sahalinin oblasti (alue) Venäjällä sekä Korean niemimaa, Koillis-Kiina ja Japani (Shabalina ym. 2017). Isäntäpuina näillä seuduilla ovat erityisesti ohotan- ja ussurinpihta (Abies nephrolepis (Trautv. ex Maxim.) Maxim. ja A. holophylla Maxim.) sekä yleisesti myös honshun- ja momipihta (Abies mariesii Mast. ja A. firma Siebold ja Zucc.), jotka kaikki näyttävät sietävän kuoriaista hyvin (Baranchikov ym. 2012). Taigamonikirjaaja hyödyntää näillä alueilla luonnonhäiriöitä, kuten myrskytuhoja tai sieni-infektioita, ja asuttaa etupäässä heikentyneitä isäntäpuita (Nobuchi 1966; Kononov ym. 2016). Sen luontaisella levinneisyysalueella sitä ei pidetä taloudellisesti merkittävänä puustotuhojen aiheuttajana (Krivets ym. 2015a,b). Kuoriainen kykenee asuttamaan koko puun latvaosia lukuun ottamatta. Japaninpihdalla (Abies veitchii Lindl.) puun läpimitta vaikuttaa kuoriaisesiintymän voimakkuuteen niin, että ulostuloreikiä on enemmän pienissä kuin suurissa puissa, ja pienet puut ovat ylipäätään useammin asuttuja (Takagi ym. 2018). Noin 70–80 %:lla japaninpihdoista löytyi Takagin ym. (2018) tutkimuksessa merkkejä taigamonikirjaajasta, ja noin puolet puista kuoli.
2.2 Isäntäpuiden puolustusmekanismit ja hyönteisten elinkierto
Puut puolustautuvat kasvinsyöjiä vastaan mm. erilaisin puolustusyhdistein, joiden koostumus vaihtelee lajeittain. Niiden avulla esimerkiksi paperikoivu kestää pronssijalosoukkoa selvästi paremmin kuin rauduskoivu (Miller ym. 1991), sillä sen puolustusyhdisteet voivat jopa tappaa pronssijalosoukon toukkia (Muilenburg ym. 2011). Paperi- ja rauduskoivun puolustusfenoleista kolme löytyi vain paperikoivulta (diaryyliheptanoidi-heksosidi, kumarylikiinihappo, ja betylosidi-pentosidi) ja kuusi muuta oli sellaisia, että niiden pitoisuus oli paperikoivulla olennaisesti korkeampi (Muilenburg ym. 2011). Fenolikoostumus kuitenkin vaihteli paljon molempien puulajien sisällä. Toisaalta Muilenburg ym. (2013) eivät havainneet paperi- ja rauduskoivun välillä eroja vertaillessaan puolustusyhdistekoostumusta, mekaanisesti aiheutetun pintavaurion umpeutumista ja rungolle levitettyä pronssijalosoukon toukkahomogenaattia. Muita puiden puolustusmekanismeja ovat mahlan virtauksen kiihdyttäminen ja suojaavan solukon nopea kasvattaminen vauriokohtaan, kuten pronssijalosoukon munintareikään. Mahlan virtaus ja puun solukon nesterakkulat voivat estää toukkien asettumista puulle (Hanks ym. 1999; Morewood ym. 2004). Kaarnan vauriokohdan nopea umpeutuminen taas voi teoriassa jopa tappaa jalosoukon toukkia (Biggs ym. 1984). Umpeutumisprosessi meikäläisillä koivuilla lienee melko hidasta, mutta vauriokohdassa runsastuva mahlan virtaus ja bakteerimassa voisivat kenties tappaa toukkia. Fenoliyhdisteillä voi myös olla yhteisvaikutuksia, joten yksittäisen fenolin merkitystä on vaikea arvioida, mutta laboratoriokokeet voisivat antaa tähän valaistusta. Lisäksi fenolien ja indusoidun puolustusreaktion – kuten mahlavirtauksen – suhteellinen merkitys tunnetaan heikosti.
Pronssijalosoukon elinkierto on yhdestä kahteen vuotta, ollen pidempi pohjoisempana ja toisaalta isäntäpuiden ollessa parempikuntoisia (Muilenburg ja Herms 2012 ja viitteet siinä). Laji on tehokas lisääntyjä: jo yksi parittelu saa naaraan tuottamaan maksimimäärän munia (Rutledge ja Keena 2012). Aikuiset lentävät touko-kesäkuussa Kentuckyn, Ohion ja Michiganin alueilla Yhdysvalloissa, mutta noin kuukautta myöhemmin pohjoisempana New Brunswickissa Kanadassa (Akers ja Nielsen 1984; Muilenburg ja Herms 2012). Lento alkaa kevään lämpösummakertymän saavuttaessa noin 276–278 astepäivää, kun kynnysarvoksi otetaan 10 °C (EPPO 2011; Muilenburg ja Herms 2012). Aikuiset elävät 2–5 viikkoa ja käyttävät tänä aikana ravintonaan mm. koivujen ja pajujen lehtiä; tavallisesti puu menettää tämän seurauksena vain vähän lehtiä (Muilenburg ja Herms 2012). Pennsylvaniassa pronssijalosoukon munia tavataan rauduskoivuilta kesäkuun puolivälistä elokuun puoliväliin, ja toukkia tavataan puilta ympäri vuoden (Loerch ja Cameron 1984). Munia löytyy pääasiassa kaarnanraoista runkojen varjoisista osista, ja toukat kuoriutuvat noin kahdessa viikossa (ibid.). Toukkia tavataan puiden eri puolilta ja korkeuksilta, ja neljännen, koteloitumaan valmistautuvan toukkavaiheen yksilöitä havaitaan lähinnä runkojen lounaissivuilla (Loerch ja Cameron 1984). Toukkavaiheita pronssijalosoukolla on neljä (jopa 5–6). Kaikki vaiheet voivat talvehtia, mutta yleisimmin kuoriainen talvehtii neljännen esikotelovaiheen toukkana (Loerch ja Cameron 1983a; Muilenburg ja Herms 2012). Koteloituminen edellyttää pakkasjaksoa; 2–3 viikon kotelovaihe ajoittuu huhti-kesäkuuhun. Eri kehitysvaiheiden kylmänsieto tunnetaan huonosti, mutta lajia tavataan säännöllisesti mm. Alaskassa ja kaikissa Kanadan eteläisissä territorioissa (Muilenburg ja Herms 2012), mikä viittaa siihen, että se luultavasti menestyisi ainakin eteläisimmässä Suomessa.
Siperianmäntykehrääjän elinkierto on yleisimmin 2–3 (jopa 5) vuotta, etelämpänä ja lämpiminä vuosina yksivuotinen (Rozhkov 1963; Jeger ym. 2018). Elinkierron pituuden määräävät tekijät tunnetaan huonosti, mutta ilmasto lienee tärkeimpiä. Yksivuotisuus mahdollistuu, kun kynnysarvolla 10°C laskettua lämpösummaa kertyy 2200 astevuorokautta. Tämä voi myös nostaa massaesiintymän mahdollisuutta, koska lisääntyminen nopeutuu. Aikuiset lentävät ja naaraat munivat touko–kesäkuussa. Toukkavaiheita on yleisimmin kuusi (Rozhkov 1963). Toukat ruokailevat puissa neulasia syöden kesäkuusta myöhään syksyyn, minkä jälkeen ne laskeutuvat pääosin karikkeeseen talvehtimaan. Seuraavana keväänä ne nousevat jälleen puihin, syövät läpi kesän ja palaavat takaisin karikkeeseen talvehtimaan. Tämän toisen talven jälkeen, huhti–toukokuussa, toukat nousevat uudelleen puihin, ruokailevat, koteloituvat puiden latvuksiin tai oksille ja kuoriutuvat kesäkuun alussa. (Jeger ym. 2018.) Koska yksilöt talvehtivat lumen alla, talvipakkaset meikäläisessä ilmastossa eivät liene perhoselle liian kovia.
Taigamonikirjaajan elinkierrossa on sekä tyypillisen kaarnakuoriaisen että siitä poikkeavia piirteitä. Lajilla on kaksivuotinen elinkierto ainakin Länsi-Siperiassa (Kerchev 2014). Parittelua ohjaavat lajityypilliset feromonit ja mahdollisesti yksilöiden mekaanisesti tuottamat 2000–20 000 Hz äänet, jotka siis ovat ihmiskorvan taajuusalueella (stridulaatio; Kerchev 2020a, 2020b). Kuoriaisyksilöt tuottavat näitä ääniä esimerkiksi hankaamalla sääriään peitinsiipien reunoihin. Äänet lienevät lajille ominaisia ja eroavat eri tilanteissa; esimerkiksi stressaantuneina tai paritteluun valmistautuessaan yksilöt ääntelevät eri tavoin (Kerchev 2019). Käytävistö koostuu yleisimmin yhden koiraan ja muutaman naaraan aikaansaamasta kuviosta (Kerchev 2014). Naaras kaivaa yleensä kaksi emokäytävää ja munii niihin 30–60 munaa. Emokäytävä on pystypuussa vaakasuora, ja emo munii sen molemmin puolin. Toukat kaivavat käytävänsä kohtisuoraan emokäytävästä ja koteloituvat toukkakäytävän loppupäähän. Aikuistuttuaan taigamonikirjaaja syö kuoren alaista nilakerrosta, kunnes saavuttaa sukukypsyyden ja poistuu kaivamansa ulostuloreiän kautta puusta. Nuoret aikuiset tai toukat talvehtivat kuoren alla. Populaatio kehittyy usein melko yhtäaikaisesti, mutta toisinaan yhdessä ja samassa puussa voi yhtä aikaa esiintyä toukkia, koteloita ja nuoria aikuisia. Talvehtivat yksilöt selviävät ainakin –37,3 °C:n lämpötilasta. (Kerchev 2014.)
2.3 Lajien luontaiset viholliset
Pronssijalosoukolla on lukuisia luontaisia vihollisia, mutta niiden vaikutukset kannan kokoon tunnetaan huonosti (Muilenburg ja Herms 2012). Loispistiäisten aiheuttama pronssijalosoukon munien kuolleisuus saattaa ylittää 50 prosenttia ja olla toukillakin viidennes (Muilenburg ja Herms 2012). Loerch ja Cameron (1983) tutkivat pronssijalosoukon loislajistoa ja toukkiin kohdistuvaa saalistusta maasto-olosuhteissa Pennsylvaniassa. Munista kaikkiaan vajaa viidennes oli loisittuja; niiltä tavattiin Ooencyrtus Ashmead ja Avetianella Trjapitzin -sukujen kiilupistiäisiä, ahmaspistiäislajia (Encyrtidae) sekä Phasgonophora sulcata Westwood ja Atanycolus charus Riley -loispistiäisiä. Myös Triapitsyn ym. (2015) kuvasivat useita pohjoisamerikkalaisia jalokuoriaisten loispistiäisiä, joista Oobius whiteorum Triapitsyn ex Triapitsyn, Petrice, Gates & Bauer löytyi pronssijalosoukon munista pennsylvanialaisilla rauduskoivuilla, jotka oli tuotu puistopuiksi. Tikkojen saalistus näyttää kuitenkin olevan merkittävämpää kuin loisinta: se voi alentaa talvehtivaa toukkapopulaatiota jopa 60 % (Muilenburg ja Herms 2012).
Siperianmäntykehrääjän massaesiintymän alkaessa hiipua esimerkiksi heikentyvän sää- tai ravintotilanteen myötä voivat loispistiäiset, sienitaudit, virukset ja bakteerit tuhota yli 90 % munista ja toukista (Pavlov ym. 2018). Siperianmäntykehrääjältä tunnetaan kymmeniä eri kehitysvaiheiden loisia (Kolomiets 1962). Esimerkiksi Telenomus gracilis Mayr -loispistiäistä pidetään tärkeänä perhosen populaatiodynamiikan säätelijänä, ja se tuhoaa pääosan munista (Kolomiets 1962; Boldaruyev 1969). Perhoselta tunnetaan myös muita loispistiäisiä ja taudinaiheuttajia, mutta niiden merkitystä kannansäätelijöinä ei tunneta (Golosova 2003).
Taigamonikirjaajan toukkakäytävistä on löydetty lukuisia kaksisiipislajeja (Diptera), joista osa saalistaa taigamonikirjaajan munia ja toukkia, kuten Medetera penicillata Negrobov, M. excellens Frey, M. pinicola Kowarz, Xylophagus cinctus (De Geer) ja Toxoneura ephippium (Zetterstedt) (Krivosheina ym. 2018). Lisäksi useat muut lajit saalistavat taigamonikirjaajan muita kuin aikuisvaiheita kuoriaisen alkuperäisellä levinneisyysalueella. Näitä ovat mm. meilläkin esiintyvät Thanasimus Latreille -suvun muurahaiskuoriaiset sekä useat sepät (Elateridae) ja niiden toukat (Kerchev 2014). Tämän saalistuksen merkitystä taigamonikirjaajan kannansäätelyssä ei tunneta. Lisäksi taigamonikirjaajalla loisii Sychnotylenchus Rühm -suvun sukkulamato (Anguinidae), joka ei yksinään juuri nosta isäntälajin kuolleisuutta, mutta voi altistaa kuoriaisen hyönteistauteja aiheuttavalle Beauveria bassiana (Bals.-Criv.) Vuill. -sieni-infektiolle (Kerchev ym. 2017). Tämä sieni tarttuu yleisimmin taigamonikirjaajien kotelovaiheessa aiheuttaen joskus kuoriaisten massakuolemia (Ansari ym. 2004; Jabbour ym. 2011; Shimizu ym. 2013).
3 Kolme näkökulmaa tarkasteltavien lajien aiheuttamille riskeille
3.1 Riskit eurooppalaisille puulajeille
Yhdysvalloissa pronssijalosoukolle kelpaavat kotoperäisiä puulajeja paremmin puistopuiksi tuodut, euraasialaiset siperian-, hies-, raudus-, himalajan-, monarkki- ja sichuaninkoivut (vastaavasti Betula platyphylla Sukaczev, B. pubescens, B. pendula, B. utilis D. Don, B. maximowicziana Regel ja B. szechuanica (C.K. Schneid.) Jansen), kuolleisuuden noustessa usein lähelle sataa prosenttia (Dirr 2009; Nielsen ym. 2011). Kotoperäisiin koivuihin verrattuna huomattavan korkea kuolleisuus voi johtua yhteisen evolutiivisen historian puuttumisesta pronssijalosoukon kanssa. Lisäksi Pohjoismaissa ja Venäjällä pronssijalosoukon potentiaaliset isäntäpuut – koivut – ovat monin paikoin varsin runsaita, missä tilanteissa vihollisista, kuten loisista, ei välttämättä ole suurta hyötyä kuoriaisen massaesiintymän hillinnässä (Bauer ym. 2015). Nämä ovat huonoja uutisia kotoperäisten koivujemme kannalta ja viittaavat siihen, että Eurooppaan kotiutuessaan pronssijalosoukko voisi aiheuttaa merkittäviä puustotuhoja.
Kirichenko ym. (2009) testasivat laboratoriossa eurooppalaisten puulajien soveltuvuutta siperianmäntykehrääjän toukkien ravinnoksi. He havaitsivat perhosen suosivan siperianlehtikuusta, mutta myös saksan- ja kaukasianpihta (Abies alba Mill. ja A. nordmanniana (Steven) Spach) ja metsäkuusi kelpasivat sille; yllättäen euroopanmustamänty (Pinus nigra J.F. Arnold) ja metsämänty kelpasivat huonosti. Tarhataimilla tehdyissä kokeissa toukat kehittyivät, koteloituivat ja kuoriutuivat kaikilta edellä mainituilta puulajeilta (Kirichenko ym. 2011) vaihdellen suurin piirtein sen mukaan, miten hyvin puulajit olivat kelvanneet toukille. Länsi-Siperiassa toukkia on löydetty siperianpihdan (Abies sibirica Ledeb.) ohella siperiankuuselta (Picea obovata Ledeb.) sekä siperianlehtikuuselta ja siperiansembralta (Pinus sibirica (Ledeb.) Turcz), mutta ei tiettävästi metsämännyltä tai metsäkuuselta (Kharuk ym. 2004, 2007).
Ensimmäiset taigamonikirjaajan aiheuttamat siperianpihdan kuolemat todettiin Keski-Venäjällä, Krasnojarskin aluepiirissä vuonna 1976, ja tällä hetkellä kuoriaisen vaikutuspiirissä on kolmannes siperianpihdan levinneisyydestä (Krivets ym. 2015c; Shabalina ym. 2017). Näin ollen sopeutuminen tähän uuteen isäntäpuulajiin vei enintään 30–40 vuotta (Pavlov ym. 2020). Venäjän siperianpihtametsissä havaittuja massaesiintymiä edelsivät nopeasti heikentynyt puiden kasvu ja maaperän kuivuminen, minkä jälkeen kuoriaiset ensisijaisesti iskivät kumpareilla kasvaneisiin, kuivuudesta eniten kärsineisiin pihtoihin, puiden kuolleisuuden lopulta saavuttaessa 75 % (Kharuk ym. 2019). Laji iskeytyy hanakasti myös pienikokoisiin siperianpihtoihin, oletettavasti siksi, että pienemmät puut kärsivät kuivuudesta nopeammin kuin suuret, ja toisaalta niiden kaarna on ohuempi, mahdollistaen pienikokoiselle kaarnakuoriaiselle puun asuttamisen (Debkov ym. 2020). Debkov ym. (2020) havaitsivat lisäksi, että kuolleet puuyksilöt olivat ainakin jossain määrin ryhmittäin eivätkä satunnaisesti. Ryhmittäisyys voi johtua kasvupaikkojen kuivuusvaihtelusta, ravinteisuudesta tai muista puiden kunnolle ja kasvulle merkittävistä ympäristötekijöistä. Siperiassa leviävän taigamonikirjaajan geneettinen vaihtelu on vähäistä ja osapopulaatiot geneettisesti eriytyneitä (Kononov ym. 2016), mikä viittaa useisiin saapumiskertoihin eri lähtöalueen osista. Euroopan Venäjän populaatiot ovat geneettisesti lähellä näitä siperialaisia populaatioita (Kononov ym. 2016). Laji näyttää Venäjällä levinneen puutavaran rautatiekuljetuksissa Moskovan (Chilakhsaeva 2008) ja mahdollisesti myös Pietarin seudulle (Mandelshtam ja Popovichev 2000). Näillä seuduilla sitä on löytynyt siperian- ja palsamipihdalta, mutta myös metsäkuuselta (Gninenko ym. 2010; Krivets ja Kerchev 2011; Kerchev 2014). Lisäksi taigamonikirjaajan on havaittu lisääntyneen onnistuneesti metsämännyllä (EFSA 2020; Kerchev 2012). Kerchev (2012) myös havaitsi eri puulajeja vertailleessa laboratoriokokeessaan siperian- ja dahurianlehtikuusen kelpaavan taigamonikirjaajalle.
3.2 Vaikutukset metsäekosysteemeihin
Tarkasteltavista lajeista siperianmäntykehrääjää ja taigamonikirjaajaa on tutkittu verraten paljon siitä näkökulmasta, miten niiden massaesiintymät vaikuttavat luonnonprosesseihin, kuten metsäpaloihin, sekä metsien rakenteeseen. Yleisellä tasolla nämä vaikutukset eivät merkittävästi eroa esimerkiksi kirjanpainajan tai mäntypistiäisten vaikutuksista. Lisätutkimusta tarvittaisiin esimerkiksi metsäpalo- ja muiden luonnonhäiriökytköksien sekä toisaalta lajiyhteisöjen sisäisten vuorovaikutuksien osalta.
Metsäpaloriskin suhteen tutkijoiden näkemyksissä on eroja. Kharuk ja Antamoshkina (2017) havaitsivat siperianmäntykehrääjän puustotuhoalan Jenisei- ja Angara-jokien välisellä alueella kasvaneen neljässä vuodessa noin 460 000 hehtaariin. Heidän arvionsa mukaan tutkitulla noin 500 hehtaarin alueella metsäpaloriski olisi puiden kuivumisen takia seitsenkertaistunut, joskin heidän verrokkialueensa oli pinta-alaltaan nelinkertainen (Kharuk ja Antamoshkina 2017). Puiden kuivumisen takana on pitkään jatkuva kuumuus ja kuivuus, jotka heikentävät puita tuholaisille otollisiksi (Kolomiets 1962; Furyaev 1966; Kharuk ym. 2016). Toisaalta Koillis-Kiinan havumetsissä siperianmäntykehrääjän lähilajin D. superans Butler massaesiintymät näyttivät vähentävän metsäpaloriskiä. Chen ym. (2011) mallinsivat metsäpalodynamiikkaa ja metsärakenteita 300 vuoden ajanjaksolle, jona D. superans-massaesiintymät yleistyvät. Heidän tuloksensa viittaavat siihen, että massaesiintymän seurauksena pienikokoinen ja herkimmin syttyvä puuaines vähenee ja näin myös metsäpalot vähenevät, mutta toisaalta lehtikuusi vähenee koivujen kustannuksella, ja etenkin vanhimmat lehtikuusiluokat vähenevät voimakkaasti.
Tuholaisten massaesiintymät voivat vaikuttaa myös metsäekosysteemien lajiyhteisöjen runsaussuhteisiin ja koostumukseen. Krasnoshchekov ja Vishnyakova (2003) selvittivät siperianmäntykehrääjän toukkien ulosteiden vaikutuksia metsämaahan lisäämällä ulosteita karikkeeseen. Koe osoitti karikkeessa elävien pieneliöiden runsastuvan ja vesiliukoisten hiiliyhdisteiden huuhtoutumisen kasvavan. Nämä muutokset näkyivät pitemmällä aikavälillä kenttäkerroskasvillisuuden muutoksina, mitkä ainakin osittain olivat seurausta toukkien ulosteiden aiheuttamasta ravinnelisäyksestä. Japanissa taigamonikirjaajan taas on havaittu olevan osa monimutkaista, pihtakuusissa elävää ekologista verkkoa, jossa on useita muita kaarnakuoriais- ja sienilajeja. Tokuda ym. (2008) havaitsivat, että Parendaeus abietinus Kojima & Morimoto -kärsäkkään aiheuttamaa momipihdan neulaskatoa ja oletettavasti puiden kunnon heikkenemistä seurasi taigamonikirjaajainfektio, joka tappoi puita. Samoilta puilta tavattavien taigamonikirjaajan sekä sikäläisten Cryphalus Erichson ja Dryocoetes Eichhoff -kaarnakuoriaisten yksilöiden on havaittu vaihtelevan seuralaissienilajeja keskenään (mm. Masuya ym. 2013). Kaarnakuoriaisia tai sieniä ei kuitenkaan pidetä pääsyinä esimerkiksi pihtakuusten joukkokuolemiin Japanissa (Ohtaka ym. 2006). Siperianpihtametsien uudistumista taigamonikirjaajan epidemian jäljiltä vaikeuttaa mm. se, että kuoriaisen suosiossa on alikasvos eli melko pienikokoiset puut. Toisaalta taimettumiseen vaikuttaa myös pohja- ja kenttäkerroskasvillisuus, joka muuttuu tuholaisen massaesiintymän myötä voimakkaasti, koska valaistus-, vesi- ja ravinteisuusolot muuttuvat. Esimerkiksi isokokoiset ruohokasvit menestyvät ja pienikokoiset vähenevät näillä kohteilla (Shabalina ym. 2017).
3.3 Metsätuhoriskit Suomessa
Kuten edellä kuvailimme, pronssijalosoukko suosii Pohjois-Amerikassa eurooppalaisia koivuja, mutta siperianmäntykehrääjällä ja taigamonikirjaajalla vastaavaa mieltymystä lähtöalueillaan ei ole; kuitenkin metsämänty ja metsäkuusi ovat kelvanneet niille koeolosuhteissa (Taulukko 1). Taigamonikirjaajan nopea kyky hyödyntää kokonaan uudentyyppistä isäntäpuuta toki viittaa lajin suureen sopeutumiskykyyn ja siten vähintään teoreettiseen uhkaan kotimaisille havupuille. Näyttää siis siltä, että pronssijalosoukko olisi Suomeen kotiutuessaan merkittävä uhka metsille, mutta kahden muun lajin muuntuminen uhkaksi edellyttäisi sopeutumista uusiin isäntäpuihin. Puutavaran ja puisten pakkausmateriaalien yleiset kuljetukset joka tapauksessa luovat reitin kaikkien kolmen saapumiselle Suomeen (Taulukko 1).
On hyvä huomata, että puustokuolemia mahdollisesti aiheuttavia vieraslajeja on enemmän kuin kolme käsittelemäämme, joskaan niitä ei useinkaan ole luokiteltu karanteenituhoojiksi. Yleisellä tasolla niiden seuranta, varhainen havaitseminen ja torjunta onnistuvat samalla tavoin. Esimerkiksi aasialainen lehtikuusten laji Ips subelongatus Motschulsky on kaarnakuoriainen, jota Euroopassa kannattaa pitää silmällä (Vanhanen ym. 2008).
Tuhoja oletettavasti tavattaisiin Suomessa samankaltaisissa olosuhteissa ja kohteilla kuin mihin lajeja koskeva tähänastinen tutkimus viittaa (Taulukko 1). Kuivuus ja kuumat kesät ovat massaesiintymille usein ratkaisevia sysäyksiä. Esimerkiksi Kharuk ym. (2017) tulkitsivat edeltäneiden kesien poikkeuksellisen kuumuuden ja kuivuuden olleen ratkaisevia siperianmäntykehrääjän kaikkiaan 2,5 miljoonan hehtaarin massaesiintymän synnyssä Jenisei-joen eteläisillä lähialueilla. Samoissa metsissä runsastui voimakkaasti myös taigamonikirjaaja, mikä sekin osaltaan heikensi ja tappoi puita (Kharuk ym. 2018). Toisaalta maastonmuodoilla on suuri merkitys. Esimerkiksi Kharuk ym. (2007) havaitsivat, että siperianmäntykehrääjän massaesiintymäkohteet olivat useimmiten melko jyrkillä rinteillä. Kharuk ym. (2018) raportoivat massaesiintymien olevan yleisempiä lounaisrinteillä. Näyttääkin siltä, että puiden kuivumiselle altistavat maastonpiirteet ylipäätään suosivat puustotuholaisia; esimerkiksi Suomessa tämä on osoitettu pilkkumäntypistiäisellä (Diprion pini L.; Kosunen ym. 2017). Ilmaston muuttuminen lämpimämpään ja kuivempaan suuntaan oletettavasti lisäisi tässä tarkasteltavien lajien mahdollisuuksia aiheuttaa merkittäviä puustotuhoja, mikäli ne Suomeen päätyisivät.
Kaikki kolme lajia luultavasti kykenisivät levittäytymään nopeasti ilman ihmisen apua, jos ne Suomeen saapuisivat. Pronssijalosoukon levittäytymistehosta tosin ei ole paljoa tietoja, mutta lähilaji saarnenjalosoukon yksilöt kykenevät siirtymään useita kymmeniä kilometrejä; pronssijalosoukon oletetaan olevan yhtä tehokas levittäytyjä (Muilenburg ja Herms 2012). Levittäytymistä tehostavat sopivien isäntäpuiden yleisyys sekä nk. Allee-vaikutus: kuoriaisen kanta kasvaa sitä nopeammin, mitä tiheämmässä paikalla on yksilöitä. Tämä selittyy sillä, että parinvalinta ja lisääntyminen onnistuvat helpoimmin, kun kanta on tiheä (Stephens ym. 1999). Suurten järvien alueella Yhdysvalloissa kesän 1988 kuivuusjakson seurauksena pronssijalosoukon vuoksi kuoli noin 105 miljoonaa koivua (Jones ym. 1993). Yksi merkittävä tuhoa kasvattanut tekijä lienee ollut samanikäisten puiden ryhmittäinen heikkeneminen (Muilenburg ja Herms 2012). Tämän voi aiheuttaa esimerkiksi kasvupaikan kuivuus.
Siperianmäntykehrääjä näyttää levittäytyvän Venäjällä luontaisesti – yksilö voi matkata lentäen kymmeniä kilometrejä – ja ihmisen avustamana, eritoten taimi- ja puutavarakuljetuksien mukana (Jeger ym. 2018). Kazakstanissa on jo paikallisia esiintymiä, ja lajin odotetaan levittäytyvän aikanaan myös Suomeen, Valko-Venäjälle ja Baltian maihin (CABI 2020). Siperiassa perhosen levinneisyys on laajentumassa 63. leveyspiirille (Kharuk ym. 2017, 2018) ja tuhoja esiintyy vuoristossa aiempaa korkeammalla (Kharuk ym. 2020). Mikkola ja Ståhls (2008) ovat kuitenkin arvelleet levittäytymisen länteen epätodennäköiseksi neljällä perusteella: levittäytymisestä ei tuolloin ollut suoria havaintoja, soveliaat isäntäpuulajit puuttuvat, ilmaston mantereisuus vähenee nopeasti ja mäntykehrääjä loisineen mahdollisesti kilpailee sen kanssa. Myös norjalaiset ovat arvioineet leviämisriskin maahansa vähäiseksi (Flø ym. 2020). Toisaalta Möykkysen ja Pukkalan (2014) simulointimallin mukaan perhosen leviäminen Baltian maihin ja Suomeen on teoriassa mahdollista. Siperianmäntykehrääjä on tässä artikkelissa tarkasteltavista lajeista ainoa, joka on laajentanut levinneisyysaluettaan etupäässä itse ja saattaa levittäytyä myös Suomeen omin avuin. Se olisi tällöin määritelmän mukaan tulokas-, ei vieraslaji.
Todennäköisin taigamonikirjaajan ja monen muun Euroopan ulkopuolisen kaarnakuoriaislajin leviämisväylä Suomeen lienee saastunut, vastakaadettu havupuutavara, jota ihminen voi tehostaa kuljettamalla puutavaraa satoja kilometrejä paikasta toiseen (Siitonen 1990; EPPO 2014; EFSA 2020). Erityisesti kuorellista puuta pidetään riskitavarana, kuorettomassa puussa riski sitä vastoin on vähäinen. Toistaiseksi taigamonikirjaajaa ei ole havaittu Suomen tuontivalvonnassa eikä metsäkartoituksissa. Tuorein havainto taigamonikirjaajan aiheuttamasta varsinaisesta tuhosta on Venäjän Euroopan puoleisesta osasta, Udmurtiasta, joka sijaitsee noin tuhat kilometriä Moskovasta itään. Vaikka tämä esiintymä löydettiin äskettäin, sen epäillään levinneen alueelle jo vuosia aiemmin rautatiekuljetusten mukana (Dedyukhin ja Titova 2021). Venäjältä tuotavan havupuun tuleekin tuontivaatimusten mukaan olla peräisin alueilta, joilla ei tavata EU:ssa esiintymättömiä kaarnakuoriaislajeja (eikä ei-eurooppalaisia pikikärsäkäs- tai tukkijäärälajeja), tai olla kuorittu tai kuivattu ((EU) 2019/2072).
Taigamonikirjaajan aikuiset kykenevät lentämään vähintään useita kilometrejä yhden vuoden aikana, ja asettumista helpottavat puiden kunnolle epäedulliset olosuhteet (EFSA 2020). Siperianpihdan levinneisyysalueella asettumista ovat auttaneet monet puita heikentävät tekijät, ja siperianpihdan väheneminen näyttääkin monen osatekijän summalta. Esimerkiksi kuivuuden ja taigamonikirjaajan vaivaamissa siperianpihtametsissä havaitaan usein myös siperianmäntykehrääjän tappamia puita (Kharuk ym. 2017, 2018). Tällä hetkellä Krasnojarskin aluepiirissä pihtoja on kuollut yli puoli miljoonaa hehtaaria ja potentiaalia on kolminkertaiseen pinta-alaan (Pavlov ym. 2020). Pääsyinä oletetaan olevan mesisieni ja juurikääpä (Heterobasidion Bref.) yhdessä ilmaston lämpenemisen, metsien käytön, pihtojen ikääntymisen ja taigamonikirjaajan kanssa.
Melko tasarakenteisten talousmetsien puustodynamiikka poikkeaa boreaalisten luonnonmetsien dynamiikasta, koska puiden ikä- ja lajirakenne sekä tilajakautuminen ovat erilaisia. Tämä voi joissakin tapauksissa johtaa suuruusluokaltaan ja vaikutuksiltaan totaalisempiin puustokuolemiin. Taloudellisesta näkökulmasta olisi huomioitava esimerkiksi se, mitkä ovat metsänomistajan tai valtionhallinnon vaihtoehdot – taloudellisine ja logistisine rajoituksineen – kussakin massaesiintymätapauksessa. Laaja-alainen varttuneen metsän tuho johtaisi kerralla suuren puumäärän tuloon markkinoille. Tällöin metsänomistaja ei todennäköisesti saisi puusta kovin hyvää hintaa, ja kuollutta ja heikentynyttä puuta jäisi osin tästä syystä metsään suuria määriä. Mahdollisena jatkoseurauksena esiintymä saattaisi laajentua ja pitkittyä, koska isäntäpuita voi olla sopivan ikäisissä ja -lajisissa talousmetsissä tarjolla todella paljon.
4 Vieraslajihyönteisten torjunta tuontivihollisilla ja kemiallisesti
Saarnenjalosoukon torjunnassa on Pohjois-Amerikassa tällä vuosituhannella käytetty Aasiasta tuotuja loispistiäisiä Spathius agrili Yang, Spathius galinae Belokobylskij & Strazanac ja Oobius agrili Zhang & Huang, jotka loisivat myös pronssijalosoukon munia ja toukkia; sitä vastoin saarnenjalosoukolla hyvin toimiva Tetrastichus planipennisi Yang ei näytä loisivan pronssijalosoukkoa (Bauer ym. 2015; Duan ym. 2018). Myös itävenäläistä Oobius primorskyensis Yao & Duan -loispistiäistä on käytetty etupäässä saarnenjalosoukon hillinnässä, mutta se loisii myös pronssijalosoukolla, ja karanteeniolosuhteissa noin 40 % pronssijalosoukon munista oli loisittu (Duan ym. 2019). Silk ym. (2020) testasivat saarnenjalosoukolla käytettyä makrosyklistä laktonia ((3Z)-dodecen-12-olide ((3Z)-lactone)) ja kaulattuja koivuja pronssijalosoukon houkuttimina ja havaitsivat, että vain kaulatut puut toimivat. Eri värisistä liima-ansoista vihreät toimivat parhaiten (ibid.). Monet puille ruiskutettavat kemikaalit toimivat jalosoukkojen hillitsemisessä vaihtelevasti, esimerkiksi atsadiraktiini, dimetoaatti, emamektiinibentsoaatti, lindaani tai permetriini (Muilenburg ja Herms 2012). Näistä ainoastaan atsadiraktiini ja emamektiinibentsoaatti ovat hyväksyttyjä EU:ssa, mutta kummallakaan ei ole rekisteröityä käyttökohdetta Suomessa.
Pavlov ym. (2018) eristivät kuolleista siperianmäntykehrääjän toukista Beauveria bassiana -sientä ja järjestivät sienen tehoa tutkivan laboratoriokokeen. Toukkien liikkuvuus väheni muutamassa päivässä sienikäsittelyn jälkeen merkittävästi ja kuolleisuus nousi 15–32 prosenttia, mikä oli jopa viisinkertainen verrattuna taustakuolevuuteen. Beauveria bassiana on aktiivinen laajalla lämpötila-alueella (5–37 °C) ja vaikka sen taudinaiheuttamiskyky on huipussaan 20–28 °C (Fargues ym. 1997; Kryukov ym. 2012), näyttäisi se soveltuvan siperianmäntykehrääjän biologiseen torjuntaan. Lisäksi laboratorio-oloissa sienen aiheuttama toukkakuolleisuus oli jopa neljänneksen korkeampi metsämännyllä ja metsäkuusella kuin pihtakuusella (Pavlov ym. 2018), mikä viittaa sienen käyttökelpoisuuteen esimerkiksi Suomen oloissa. Kuitenkaan kaikki eristetyt sienikannat eivät ole yhtä tehokkaita. Siperianmäntykehrääjän kannan hillitsemiskeinoista tutkittuja ovat myös feromonipyydykset ja erilaiset puille ruiskutettavat kemikaalit. Synteettisistä yhdisteistä (Z,E)-5,7-dodekadienaali houkuttelee siperianmäntykehrääjän koiraita (Kong ym. 2007). Koiraita houkuttelevat naaraiden erittämien feromonien veroisesti monet aldehydien ja alkoholien sekoitukset (64 % Z,E-5,7-dodekadienaali, 10 % Z-5-dodekenaali, 18 % E-7-dodekenaali, 8 % E-6-dodekenaali, 64 % Z,E-5,7-dodekadien-1-oli, 10 % Z-5-dodeken-1-oli, 18 % E-7-dodeken-1-oli, 8 % E-6-dodeken-1-oli) (Klun ym. 2008). Siperianmäntykehrääjän torjunnassa on Venäjällä käytetty pyretroidiyhdisteitä ja Bacillus thuringiensis Berliner -bakteeria, ja myös granuloosivirus vaikuttaa torjunnan kannalta lupaavalta (CABI 2020). Jasmonihapon ruiskutus dahurian- ja olganlehtikuuselle (Larix olgensis A. Henry) vähensi siperianmäntykehrääjän munintaa käsiteltyjen puiden rungoilla (Meng ym. 2011). Lisäksi perhosen munia loisiva pistiäinen Anastatus japonicus Ashmead oli runsaampi käsitellyillä kuin käsittelemättömillä puilla (ibid.). Feromonipyydysten ja ruiskutuskäsittelyn käyttö populaation rajoittamistarkoituksessa vaativat Turvallisuus- ja kemikaaliviraston (Tukes) luvan.
Entomopatogeenien merkitys taigamonikirjaajan kannan säätelyssä on huonosti tunnettu, mutta Länsi-Siperiassa yksilöistä ja toukkakäytävistä on löydetty ainakin Beauveria bassiana, B. pseudobassiana Rehner & Humber, Lecanicillium attenuatum Zare & Gams ja Isaria farinosa (Holmsk.) Fr. -sieniä (Kerchev ym. 2017). Kerchev ym. (2017) altistivat taigamonikirjaajia Beauveria bassiana- ja Isaria farinosa-sienille 5 ja 15 °C:n lämpötiloissa ja havaitsivat B. bassianan olevan aktiivisempi lämpötilassa 15 °C, kun taas I. farinosa oli aktiivisempi lämpötilassa 5 °C. Sienet ovat vastaavasti aktiivisia lämpötiloissa 5–37 °C (huippu 20–22 °C) ja 2–32 °C (Kerchev ym. 2017 ja viitteet siinä). Beauveria bassianan aktiivisuus on korkeimmillaan lämpötilassa 16–24 °C, ja taigamonikirjaajalla tämä sieni voi jo viikossa johtaa lähes sadan prosentin kuolleisuuteen (Pavlov ym. 2020). Tosin biologisen torjunnan kannalta harmillisesti B. bassianan aktiivisin lämpötila ei osu yksiin taigamonikirjaajan lennon optimilämpötilan kanssa (Kryukov ym. 2012). Lisäksi hyönteistauteja aiheuttavat sienet ovat usein isäntähyönteislajin suhteen generalisteja (Zimmermann 2007), joten niiden käytöllä voi olla epätoivottuja vaikutuksia esimerkiksi muuhun hyönteislajistoon. Suomessa B. bassiana -valmiste on hyväksytty ansarijauhiaisten (Trialeurodes vaporariorum (Westwood)) torjuntaan, mutta itse B. bassiana (ja sitä hyödyntävät valmisteet, kuten BotaniGard WP) on todettu haitalliseksi pölyttäjähyönteisille (Cappa ym. 2019).
5 Miten Suomessa toimitaan riskien realisoituessa?
Suomessa karanteenituhoojien mahdollisia vaikutuksia metsäluontoon on arvioitu FinnPrio-mallilla (Heikkilä ym. 2016). Siinä on arvioitu tällaisten lajien leviämisen todennäköisyyttä Suomeen, niiden maahan asettumista ja puustovaikutusten vakavuutta. Malli on kehitetty, koska rajallisin resurssein jokaiselle potentiaaliselle karanteenituhoojalle ei voida tehdä laajaa riskinarviointia. Heikkilän ym. (2016) arvion mukaan pronssijalosoukko kuuluu Suomen kannalta erityisen vahingollisiin lajeihin, jos se tänne onnistuu leviämään. Myös taigamonikirjaaja kuuluu vaikutuksiltaan Suomelle merkityksellisiin lajeihin, ja sen saapumistodennäköisyyttä pidetään mallin perusteella suurempana kuin pronssijalosoukon. Toistaiseksi Suomen ilmasto, toimiva kasvinterveyslainsäädäntö ja hyvä onnikin ovat pitäneet Suomen vapaana monesta Keski-Eurooppaa ja Pohjois-Amerikkaa kurittavasta vieraslajista.
Todennäköisyys havaita Eurooppaan puuhakekuormassa tulevia pronssijalosoukon toukkia tai koteloita on äärimmäisen pieni. Økland ym. (2012) raportoivat Norjan viranomaisten tutkineen laivalla saapuneesta hakekuormasta 58 dm3, jolloin todennäköisyys havaita toukka tai kotelo olisi 0,00005 %. Näin ollen 90 %:n havaitsemistodennäköisyys olisi Euroopan tasolla vaatinut 27 miljoonan dm3:n tutkimisen kaikkiaan 30 miljoonan kuutiometrin vuotuisesta haketuonnista! Vuonna 2019 EU:ssa voimaan tullut uusi kasvinterveyslainsäädäntö pyrkii parantamaan tilannetta tarkentamalla silmävaraisen tarkastuksen vaatimuksia. Vaatimukset edellyttävät otantaa, jossa ISPM 31 -standardissa (ISPM 2008) määritelty minimiosuus yhdestä tuotavasta kasvi- tai puutavaraerästä tulee katsoa tarkasti läpi karanteenituhoojien varalta. Otannan tehoa ja siitä tehtäviä johtopäätöksiä tarkennetaan EU:ssa jatkuvasti.
Pronssijalosoukon saapumista Eurooppaan voidaan pitää merkittävänä uhkana lehtipuuvaltaisille metsille koko Euraasian alueella, mihin viittaavat Euraasian koivujen yleisyys ja laajat levinneisyysalueet sekä tutkimuksin osoitettu herkkyys pronssijalosoukkotuhoille yhdistettynä ilmastolliseen samankaltaisuuteen Pohjois-Amerikan koivuvyöhykkeen kanssa (EPPO 2011; Økland ym. 2012). Fennoskandiaan ja EU:n alueelle laji saapuu todennäköisimmin puuhakkeen, kuorellisen puutavaran, koristepuiden tai puisen pakkausmateriaalin mukana. Saapuessaan se luultavasti levittäytyisi nopeasti laajalle alueelle aiheuttaen koivujen massakuolemia (EPPO 2011). Mahdollisia leviämisväyliä pyritään lainsäädännöllisesti tukkimaan siten, että elävien koivukasvien maahantuonti Pohjois-Amerikasta on eräitä poikkeuksia lukuun ottamatta kielletty. Puutavaralle ja hakkeelle vaaditaan Pohjois-Amerikasta tuotaessa kasvinterveystodistus. Sallittujen elävien koivukasvien mukana on oltava kasvinterveystodistus. Pohjois-Amerikasta tulevan koivupuutavaran tulee olla kuorittu siten, että pintapuusta on samalla poistettu 2,5 cm. Pohjois-Amerikasta tuotavan koivun kuoressa ei saa olla puuainesta.
Vieraslajien leviämisen estäminen on monesta syystä ensiarvoisen tärkeää. Osa Suomeen tulevasta puutavarasta kuuluu kasvinterveyslainsäädännön ja siten tuontivalvonnan piiriin. Esimerkiksi pääosa havupuu- ja kasvava määrä lehtipuusuvuista kuuluvat valvonnan piiriin alkuperämaasta riippuen (Komission täytäntöönpanoasetus (EU) 2019/2072, liite VII). Asetukseen (EU) 2019/1702 on listattu ekologisesti ja taloudellisesti merkittävimmät karanteenituhoojat, mm. siperianmäntykehrääjä ja pronssijalosoukko. Taigamonikirjaaja on listattu satojen muiden unionikaranteenituhoojien joukkoon. Näiden kolmen karanteenituhoojan isäntäpuulajeista tehtyä puutavaraa ei saa tuoda EU:n alueelle ilman kasvinterveystodistusta. Puutavaran tulee lisäksi täyttää puulajista, alkuperästä ja tuotteesta riippuen säädetyt erityisvaatimukset, joihin sisältyy esimerkiksi uunikuivauskäsittely.
Ainoa varma keino estää hyönteisten siirtyminen on lopettaa kuoripintaisen puun maahantuonti. Vaikka todennäköisyys tuholaisen havaitsemiselle tuontitavarassa on varsin pieni, rajakontrolli on tyhjää parempi viesti lähtömaalle olla laistamatta esimerkiksi lämpökäsittelyvaatimuksista. Tavoitetta estää saastuneen puutavaran tuonti auttaa sekin, jos seurantaa keskitetään riskialueille, kuten rajanylityspaikoille ja tuontisatamiin. Tähän saakka toimissa on onnistuttu melko hyvin, toki osittain luultavasti onnen kaupalla. Resursseja ei ole järkevää supistaa ja tarkastusmenetelmiä täytyy kehittää edelleen.
Peli ei kuitenkaan välttämättä ole menetetty, jos vaikkapa suomalaisesta puistosta, hautausmaalta tai pihalta löytyisi siperianmäntykehrääjä tai taigamonikirjaaja. Viranomainen määräisi lainsäädännön edellyttämät torjuntatoimenpiteet. Tällä hetkellä näitä lajeja koskevaa täytäntöönpanosäädöstä ei ole, mutta lähtökohta on karanteenituhoojien kohdalla aina sama: laji on pyrittävä poistamaan. Tämä voi onnistua yhdistämällä eri torjuntatoimenpiteitä, kuten isäntäpuulajin kaatoja ydinalueella, esiintymäalueen ympärille perustettavan puskurialueen kartoituksia visuaalisesti ja toimenpiteiden tehon seurantaa hyönteispyydyksin. Tätä jatketaan vuosien ajan, mahdollisin jatkokaadoin ja puskurialueen muutoksin, kunnes uusia havaintoja ei enää kerry. Jos torjunta osoittautuu mahdottomaksi, Euroopan komissio voi pyynnöstä harkita muita torjunnan vaihtoehtoja.
6 Mitä pitäisi Suomen näkökulmasta tutkia?
Suomen metsätalouden näkökulmasta täytyisi tietää nykyistä tarkemmin esimerkiksi tarkasteltujen lajien lämpötila- ja kosteusoptimit, samoin talviolosuhteiden sieto. Myös ulkomailta potentiaalisesti saapuvien lajien kyky luonnon oloissa hyödyntää kotoperäisiä metsäpuulajejamme sekä toisaalta näiden puiden alttius ja sietokyky ovat huonosti tunnettuja. Samoin kaikkien kolmen lajin osalta sienten, virusten ja bakteerien rooli niiden kannansäätelyssä tunnetaan erittäin huonosti, vaikka mikrobit voisivat tarjota tehokkaita biologisen torjunnan keinoja.
Vieraslajien mukana kulkeutuu muitakin lajeja kuin itse päätähti. Esimerkiksi taigamonikirjaajalla – kuten useimmilla muillakin kovakuoriaisilla – on seuralaisinaan mm. punkkeja, jotka kiinnittyvät isäntäyksilön pintaan (foreettiset lajit) tai elävät toukkakäytävissä, jolloin ne syövät käytävissä olevia sieniä (esim. Khaustov 2017; Klimov ja Khaustov 2018; Kontschan ym. 2019). Toukkakäytävissä elävien punkkien on arveltu syömisellään vähentävän sienirihmastoja ja hyönteistauteja aiheuttavia sieniä, ja isäntähyönteisen mukana kulkeutuvat punkit saattavat toisaalta levittää esimerkiksi sinistäjäsieniä (Khaustov ja Abramov 2017). Kaarnakuoriaisilla on myös lukuisia seuralaissieniä, jotka voivat heikentää tai jopa tappaa isäntäpuita. Taigamonikirjaajalla on havaittu tällaisia sieniä mm. suvuista Grossmannia Goidànich, Graphilbum Upadhyay & Kendr. ja Ophiostoma Syd. (Yamaoka ym. 2004a,b; Pashenova ym. 2018). Ainakin kuusi sienilajia lienee saapunut Länsi-Venäjälle taigamonikirjaajan mukana (Pashenova ym. 2018). Näistä sienistä Grossmannia aoshimae Ohtaka & Masuya vaivaa etenkin siperianlehtikuusta ja -pihtaa, mutta ilmeisesti myös metsämänty on vaaravyöhykkeessä; sitä vastoin siperiansembra, siperiankuusi ja metsäkuusi näyttävät olevan tälle sienelle vastustuskykyisiä (Pashenova ym. 2018). Yleisesti ottaen punkkien, bakteerien, virusten ja sienten ekologia sekä merkitys isäntäyksilön kunnolle, kasvitautien leviämiselle ja niiden kanssa tekemisissä olevalle muulle lajistolle ovat huonosti tunnettuja.
Vieraslajien biologinen torjunta on perinteisesti nojannut lajien lähtöseudulta tuotuihin saalistajiin, loisiin tai taudinaiheuttajiin. Lisälajien tuonti kuitenkin nostaa etukäteen tunnistamattomien biologisten haittojen mahdollisuutta. Tästä syystä tutkimusta tarvittaisiin myös biologiseen torjuntaan ehdotettavien lajien erikoistuneisuusasteesta halutun vieraslajin suhteen. Lisäksi lajien nykyinen levinneisyysalue, lajien seuranta siellä sekä nykyisiltä esiintymisalueilta tänne mahdollisesti johtavien leviämisreittien analysointi olisivat ensiarvoisen tärkeitä, sillä kaikki näihin asioihin liittyvä tieto helpottaa varautumista sekä torjuntatoimien suunnittelua.
Fennoskandian metsissä on vaikkapa tropiikin metsiin verrattuna hyvin vähän puulajeja, ja niitäkin määrällisesti dominoi vain muutama – metsämänty, metsäkuusi sekä hies- ja rauduskoivu. Niillä kaikilla on kuitenkin erittäin suuri merkitys metsien ekologisina avainlajeina: monet muut metsiemme eliölajit ovat niistä suoraan riippuvaisia. Lisäksi nämä puulajit ovat metsäteollisuudelle tärkeitä, ja ne ylläpitävät maisema- ja virkistysarvoja, jotka mahdollistavat esimerkiksi luontomatkailuelinkeinot. Väheksymättä muiden puulajiemme monimuotoisuus- ja monikäyttöarvoja, näiden muiden osuus metsiemme tilavuudesta on vain kolmisen prosenttia. Kuten edellä kuvailemamme lajien levittäytymis- ja sopeutumispotentiaali kertovat, tiedon tarve koskien rajojemme yli mahdollisesti saapuvia uusia, puulajejamme uhkaavia tuhonaiheuttajia on akuutti. Tutkimustiedolla varmistetaan oikein kohdistettu ja mitoitettu seuranta ja torjuntatoimet. Samalla myös osaltaan turvataan alkuperäisen metsäluontomme säilymistä.
Kiitokset
Kaksi vertaisarvioijaa ja toimitus antoivat hyödyllisiä kommentteja, joiden ansiosta käsikirjoitus parani huomattavasti.
Rahoitus
Tämän artikkelin taustamateriaali koottiin Vieraslajit – Osaamisen ja aineistojen vaihdon yhteistyöverkosto – DIAS (KA 5046) -hankkeessa. Hankkeen rahoitus oli myönnetty rajat ylittävää yhteistyötä tukevan Karelia CBC -ohjelman kautta, jota ovat yhdessä rahoittaneet Euroopan unioni, Suomi ja Venäjä.
Lähteet
Abell KJ, Bauer LS, Duan JJ, Van Driesche RG (2014) Long-term monitoring of the introduced emerald ash borer (Coleoptera: Buprestidae) egg parasitoid, Oobius agrili (Hymenoptera: Encyrtidae), in Michigan, USA and evaluation of a newly developed monitoring technique. Biol Control 79: 36–42. https://doi.org/10.1016/j.biocontrol.2014.08.002.
Akers RC, Nielsen DG (1984) Predicting Agrilus anxius Gory (Coleoptera: Buprestidae) adult emergence by heat unit accumulation. Journal of Econ Entom 77: 1459–1463. https://doi.org/10.1093/jee/77.6.1459.
Anderson RF (1944) The relation between host condition and attacks by the bronzed birch borer. Journal of Econ Entom 37: 588–596. https://doi.org/10.1093/jee/37.5.588.
Ansari MA, Tirry L, Moens M (2004) Interaction between Metarhizium anisopliae CLO 53 and entomopathogenic nematodes for the control of Hoplia philanthus. Biol Control 31: 172–180. https://doi.org/10.1016/j.biocontrol.2004.04.002.
Aukema JE, McCullough DG, Von Holle B, Liebhold AM, Britton K, Frankel SJ (2010) Historical accumulation of non-indigenous forest pests in the continental United States. Bioscience 60: 886–897. https://doi.org/10.1525/bio.2010.60.11.5.
Baranchikov YN, Kirichenko NI (2002) Feeding and growth of caterpillars of the Siberian moth Dendrolimus superans sibiricus (Lepidoptera: Lasiocampidae) during summer diapause. Entomological Review 82: 1084–1089.
Baranchikov YN, Kondakov YP, Petrenko ES (2001) Catastrophic outbreaks of Siberian moth in Krasnoyarsk Kray. Julkaisussa: Lepeshev AA (toim) National security of Russia. Znaniye, Krasnoyarskiy Kray, Moscow, s. 146–167. [Venäjäksi].
Baranchikov YN, Petko VM, Astapenko SA, Akulov EN, Krivets SA (2011) Four-eyed fir bark beetle – a new aggressive pest of fir in Siberia. Lesnoi Vestnik 80: 78–81.
Baranchikov YN, Pashenova NV, Petko VM (2012) Factors of populational dynamics in bark beetle Polygraphus proximus Blandford (Coleoptera, Scolytidae) on frontiers of its invasion. Interexpo GEO-Siberia 4: 99–103.
Baranchikov YN, Demidko DA, Laptev AV, Petko VM (2014) Decline dynamics of Siberian fir trees in the foci of four-eyed fir bark beetle. Lesnoi Vestnik 18: 132–138.
Barter GW (1957). Studies of the bronze birch borer, Agrilus anxius Gory, in New Brunswick. Canadian Entomologist 89: 12–36. https://doi.org/10.4039/Ent8912-1.
Bauer LS, Duan JJ, Gould JR, Van Driesche RG (2015) Progress in the classical biological control of Agrilus planipennis Fairmaire (Coleoptera: Buprestidae) in North America. Can Entomol 147: 300–317. https://doi.org/10.4039/tce.2015.18.
Bellamy CL (2012) Genus Agrilus Curtis 1825. A Checklist of World Buprestoidea. https://cerambycids.com/buprestidae/WorldCat/Genera/Agrilus.htm. Viitattu 8.12.2020.
Bellamy CL (2014) The world of jewel beetles. Bupstats. https://cerambycids.com/buprestidae/bupstats.html.Viitattu 8.12.2020.
Biggs AR, Merrill W, Davis DD (1984) Discussion: response of bark tissues to injury and infection. Can J For Res 14: 351–356. https://doi.org/10.1139/x02-172.
Boldaruyev VO (1969) Dinamika chislennossti sibirskogo shelkopryada i ego parazitov. AN SSSR, Ulan-Ude. [Venäjäksi].
Boyd IL, Freer-Smith PH, Gilligan CA, Godfray HC (2013) The consequence of tree pests and diseases for ecosystem services. Science 342, article id 823. https://doi.org/10.1126/science.1235773.
CABI (Centre for Agriculture and Bioscience International) (2020). Invasive species compendium. Dendrolimus superans sibiricus (Siberian silk moth) toolbox. https://www.cabi.org/isc/datasheet/18371. Viitattu 30.7.2020.
Cappa F, Petrocelli I, Dani FR, Dapporto L, Giovannini M, Silva-Castellari J, Turillazzi S, Cervo R (2019) Natural biocide disrupts nestmate recognition in honeybees. Sci Rep 9, article id 3171. https://doi.org/10.1038/s41598-019-38963-3.
Chilaksaeva EA (2008) First find of Polygraphus proximus Blandford, 1894 (Coleoptera, Scolytidae) in Moscow oblast. Bulletin of the Moscow Naturalists’ Society, Biological Section 113: 39–42.
David P, Thébault E, Anneville O, Duyck P-F, Chapuis E, Loeuille N (2017) Chapter one – impacts of invasive species on food webs: a review of empirical data. Adv Ecol Res 56: 1–60. https://doi.org/10.1016/bs.aecr.2016.10.001.
Debkov NM, Gradel A, Aleinikov AA (2020) Reconstruction of stand history and impact evaluation of an invasive bark beetle in Siberian fir forests with the help of spatial structure analysis. Lesnoy Zhurnal – Forestry Journal 3: 24–41. https://doi.org/10.37482/0536-1036-2020-3-24-41.
Dedyukhin SV, Titova VV (2021) Finding of the Bark Beetle Polygraphus proximus Blandford, 1894 (Coleoptera, Curculionidae: Scolytinae) in Udmurtia. Russian Journal of Biological Invasions 12: 258–263. https://doi.org/10.1134/S2075111721030048.
Dirr MA (2009) Dirr’s encyclopedia of trees and shrubs. Timber Press Inc.
Duan JJ, Bauer LS, Van Driesche RG (2018) Progress and challenges of protecting North American ash trees from the emerald ash borer using biological control. Forests 9 (142): 1–17. https://doi.org/10.3390/f9030142.
Duan JJ, Schmude JM, Larson KM, Fuester RW, Gould JR, Ulyshen MD (2019) Field parasitism and host specificity of Oobius primorskyensis (Hymenoptera: Encyrtidae), an egg parasitoid of the emerald ash borer (Coleoptera: Buprestidae) in the Russian Far East. Biol Control 130: 44–50. https://doi.org/10.1016/j.biocontrol.2018.12.005.
Elfving R (2020) Havununnan (Lymantria monacha) levinneisyyshistoria ja seuranta Suomessa. Pro gradu, Oulun yliopisto. http://urn.fi/URN:NBN:fi:oulu-202006182538.
EPPO (European and Mediterranean Plant Protection Organization) (2010) Agrilus anxius (bronze birch borer): addition to the EPPO Alert List. EPPO Reporting Service no. 2. https://gd.eppo.int/reporting/article-366. Viitattu 30.7.2020.
EPPO (European and Mediterranean Plant Protection Organization) (2011) Pest risk analysis for Agrilus anxius. EPPO, Pariisi. http://capra.eppo.org/files/examples/1/Agrilus_anxius.pdf. Viitattu 30.7.2020.
EPPO (European and Mediterranean Plant Protection Organization) (2014) Pest risk analysis for Polygraphus proximus. EPPO, Pariisi. http://archives.eppo.int/EPPOStandards/pra.htm. Viitattu 30.7.2020.
EFSA (European Food Safety Authority) (2020) Pest survey card on Polygraphus proximus. EFSA Supporting Publications 17, article id 1780. https://doi.org/10.2903/sp.efsa.2020.EN-1780.
Eversmann E (1844) Fauna Lepidopterologica Volgo-Uralensis. Typis Universitatis, Casani.
Fargues J, Goettel MS, Smits N, Ouedraogo A, Rougier M (1997) Effect of temperature on vegetative growth of Beauveria bassiana isolates from different origins. Mycologia 89: 383–392. https://doi.org/10.1080/00275514.1997.12026797.
Flø D, Rafoss T, Wendell M, Sundheim L (2020) The Siberian moth (Dendrolimus sibiricus), a pest risk assessment for Norway. For Ecos 7, article id 48. https://doi.org/10.1186/s40663-020-00258-9.
Furyaev VV (1966) The taiga silkworms and their scorching. Science, Moscow. [Venäjäksi].
Fält-Nardmann JJJ, Tikkanen O-P, Ruohomäki K, Otto L-F, Leinonen R, Pöyry J, Saikkonen K, Neuvonen S (2018) The recent northward expansion of Lymantria monacha in relation to realised changes in temperatures of different seasons. For Ecol Manag 427: 96–105. https://doi.org/10.1016/j.foreco.2018.05.053.
Gninenko Y (2000) Dendrolimus superans sibiricus – a threat to European forests. Lesnoe Khozyaibrevestvo 3: 50–51.
Gninenko YI, Orlinskiy AD (2002) Dendrolimus sibiricus in the coniferous forests of European Russia at the beginning of the twenty-first century. Bull OEPP 32: 481–483. https://doi.org/10.1046/j.1365-2338.2002.00593.x.
Gninenko YI, Cheelakhsaeva EA, Klukin MS (2010) New risk for European dorests – ussuryjsky bark beetle Polygraphus proximus. First Serbian Forestry Congress ‘Future with Forests’, Belgrade, Serbia, s. 1637–1633.
Golosova MA (2003) Biologicheskaya zashtita lesa. MGUL, Moscow. [Venäjäksi].
Hanks L, Paine T, Millar J, Campbell CD, Schuch UK (1999) Water relations of host trees and resistance to the phloem-boring beetle Phoracantha semipunctata F. (Coleoptera: Cerambycidae). Oecologia 119: 400–407. https://doi.org/10.1007/s004420050801.
Haynes KJ, Allstadt A, Klimetzek D (2014) Forest defoliator outbreaks under climate change: effects on the frequency and severity of outbreaks of five pine insect pests. Glob Chang Biol 20: 2004–2018. https://doi.org/10.1111/gcb.12506.
Heikkilä J, Tuomola J, Pouta E, Hannunen S (2016) FinnPRIO: a model for ranking invasive plant pests based on risk. Biol Invasions 18: 1827–1842. https://doi.org/10.1007/s10530-016-1123-4.
Herms DA, McCullough DG (2014) Emerald ash borer invasion of North America: history, biology, ecology, impact and management. Annu Rev Entomol 59: 13–30. https://doi.org/10.1146/annurev-ento-011613-162051.
ISPM (International Standards for Phytosanitary Measures) (2008) Methodologies for sampling of consignments. ISPM No. 31, CPM-3. https://www.ippc.int/static/media/files/publication/en/2016/11/ISPM_31_2008_Sampling_of_consignments_EN.pdf. Viitattu 30.7.2020.
Jabbour R, Crowder DW, Aultman EA, Snyder WE (2011) Entomopathogen biodiversity increases host mortality. Biol Control 59: 277–283. https://doi.org/10.1016/j.biocontrol.2011.07.016.
Jakuš R (1998) Types of bark beetle (Coleoptera: Scolytidae) infestation in spruce forest stands affected by air pollution, bark beetle outbreak and honey fungus (Armillaria mellea). Anz Schädlingskd Pfl 71: 41–49. https://doi.org/10.1007/BF02770619.
Jakuš R (2001) Bark beetle (Coleoptera, Scolytidae) outbreak and system of IPM measures in an area affected by intensive forest decline connected with honey fungus (Armillaria sp.). Anz Schaedlingskd Pfl 74: 46–51. https://doi.org/10.1046/j.1439-0280.2001.01008.x.
Jeger M, Bragard C, Caffier D, Candresse T, Chatzivassiliou E, Dehnen-Schmutz K, Gilioli G, Miret JAJ, MacLeod A, Navajas Navarro M, Niere B, Parnell S, Potting R, Rafoss T, Rossi V, Urek G, Van Bruggen A, Van der Werf W, West J, Winter S, Kirichenko N, Kertész V, Grégoire J-G (2018) Pest categorisation of Dendrolimus sibiricus. EFSA J 16: 5301. https://doi.org/10.2903/j.efsa.2018.5301.
Jennings DE, Duan JJ, Bean D, Gould JR, Kimberly AR, Shrewsbury PM (2016) Monitoring the establishment and abundance of introduced parasitoids of emerald ash borer larvae in Maryland, U.S.A. Biol Control 101: 138–144. https://doi.org/10.1016/j.biocontrol.2016.07.006.
Jennings DE, Duan JJ, Bean D, Kimberly AR, Williams GL, Bells SK, Shurtleff AS, Shrewsbury PM (2017) Effects of the emerald ash borer invasion on the community composition of arthropods associated with ash tree boles in Maryland, U.S.A. Agr For Entomol 19: 122–129. https://doi.org/10.1111/afe.12186.
Jones EA, Reed DD, Mroz GD, Liechty HO, Cattelino PJ (1993) Climate stress as a precursor to forest decline: paper birch in northern Michigan, 1985–1990. Can J For Res 23: 229–233. https://doi.org/10.1139/x93-030.
Kerchev IA (2012) Experimental study of the possibility of the emergence of new trophic connections of four-eyed fir bark beetle Polygraphus proximus Blandf. (Coleoptera: Curculionidae, Scolytinae) in the West Siberian region. Vestnik Tomskogo Gosudarstvennogo Universiteta Biologiya 3: 169–177. [Venäjäksi].
Kerchev IA (2014) Ecology of four-eyed fir bark beetle Polygraphus proximus Blandford (Coleoptera; Curculionidae, Scolytinae) in the West Siberian region of invasion. Russ J Biol Invasions 5: 176–185. https://doi.org/10.1134/S2075111714030072.
Kerchev IA (2019) Context-dependent acoustic signals in the four-eyed fir bark beetle, Polygraphus proximus (Coleoptera: Curculionidae: Scolytinae). Environ Entomol 48: 181–188. https://doi.org/10.1093/ee/nvy178.
Kerchev IA (2020a) Temperature-dependent parameters of stridulatory signals in the four-eyed fir bark beetle, Polygraphus proximus (Coleoptera: Curculionidae: Scolytinae). J Asia Pac Entomol 23: 380–384. https://doi.org/10.1016/j.aspen.2020.01.011.
Kerchev IA (2020b) Interspecific differences of stridulatory signals in three species of bark beetles from the genus Polygraphus Er. (Coleoptera: Curculionidae, Scolytinae) inhabiting the island of Sakhalin. PeerJ 8, article id e8281. https://doi.org/10.7717/peerj.8281.
Kerchev IA, Kryukov VY, Yaroslavtseva ON, Polovinko GP, Tokarev YS, Glupov VV (2017) The first data on fungal pathogens (Ascomycota, Hypocreales) in the invasive populations of four-eyed fir bark beetle Polygraphus proximus Blandf. Russ J Biol Invasions 8: 34–40. https://doi.org/10.1134/S2075111717010040.
Kharuk VI, Antamoshkina OA (2017). Impact of silkmoth outbreak on taiga wildfires. Contemp Probl Ecol 10: 556–562. https://doi.org/10.1134/S1995425517050055.
Kharuk VI, Ranson KJ, Kozuhovskaya AG, Kondakov YP, Pestunov IA (2004). NOAA/AVHRR satellite detection of Siberian silkmoth outbreaks in eastern Siberia. Int J Remote Sens 25: 5543–5555. https://doi.org/10.1080/01431160410001719858.
Kharuk VI, Ranson KJ, Fedotova EV (2007). Spatial pattern of Siberian silkmoth outbreak and taiga mortality. Scand J For Res 22: 531–536. https://doi.org/10.1080/02827580701763656.
Kharuk VI, Demidko DA, Fedotova EV, Dvinskaya ML, Budnik UA (2016) Spatial and temporal dynamics of Siberian silk moth large-scale outbreak in dark-needle coniferous tree stands in Altai. Contemp Probl Ecol 9: 711–720. https://doi.org/10.1134/S199542551606007X.
Kharuk VI, Im ST, Yagunov MN (2018) Migration of the northern boundary of the Siberian silk moth. Contemp Probl Ecol 11: 26–34. https://doi.org/10.1134/S1995425518010055.
Kharuk VI, Im ST, Soldatov VV (2020) Siberian silkmoth outbreaks surpassed geoclimatic barrier in Siberian Mountains. J Mt Sci 17: 1891–1900. https://doi.org/10.1007/s11629-020-5989-3.
Khaustov AA (2017) A new species of Tarsonemus (Acari: Tarsonemidae) associated with the bark beetle, Polygraphus proximus (Coleoptera: Curculionidae: Scolytinae) from the Far East of Russia. Acarologia 57: 673–687. https://hal.archives-ouvertes.fr/hal-01535851.
Khaustov AA, Abramov VV (2017) A new species and a new record of raphignathoid mites (Acari: Raphignathoidea: Camerobiidae, Stigmaeidae) occurring in the galleries of bark beetles (Coleoptera: Curculionidae: Scolytinae) from Russia. Syst Appl Acarol 22: 1385–1398. https://doi.org/10.11158/saa.22.9.6.
Klimov PB, Khaustov AA (2018) A review of histiostomatid mites associated with scolytine bark beetles (Coleoptera: Curculionidae), with a description of Histiostoma shiramba sp. n. (Acari: Histiostomatidae) from galleries of the Sakhalin-fir bark beetle Polygraphus proximus. Syst Appl Acarol 23: 2373–2410. https://doi.org/10.11158/saa.23.12.9.
Kolb TE, Fettig CJ, Ayres MP, Bentz BJ, Hicke JA, Mathiasen R, Stewart JE, Weed AS (2016) Observed and anticipated impacts of drought on forests insects and diseases in the United States. For Ecol Manag 380: 321–334. https://doi.org/10.1016/j.foreco.2016.04.051.
Kolomiets NG (1962) Parazity i khisthniki sibirskogo shelkopryada. SO AN SSSR, Novosibirsk. [Venäjäksi].
Kong XB, Zhao CH, Wang R (2007) Sex pheromone of the larch caterpillar moth, Dendrolimus superans, from northeastern China. Entomologia Experimentalis et Applicata 124: 37–44. https://doi.org/10.1111/j.1570-7458.2007.00562.x.
Kononov A, Ustyantsev K, Blinov A, Fet V, Baranchikov YN (2016) Genetic diversity of aboriginal and invasive populations of four-eyed fir bark beetle Polygraphus proximus Blandford (Coleoptera, Curculionidae, Scolytinae). Agr For Entomol 18: 294–301. https://doi.org/10.1111/afe.12161.
Kontschan J, Szocs G, Kiss B, Khaustov AA (2019) Bark beetle associated trematurid mites (Acari: Uropodina: Trematuridae) from Asian Russia with description of a new species. Syst Appl Acarol 24: 1592–1603. https://doi.org/10.11158/saa.24.9.2.
Kosunen M, Kantola T, Starr M, Blomqvist M, Talvitie M, Lyytikäinen-Saarenmaa P (2017) Influence of soil and topography on defoliation intensity during an extended outbreak of the common pine sawfly (Diprion pini L.). iForest 10: 164–171. https://doi.org/10.3832/ifor2069-009.
Krasnoshchekov YN, Vishnyakova ZV (2003) Changes in properties of soils in foci of Siberian moth (Dendrolimus sibiricus) outbreaks. Eur Soil Sci 36: 1298–1306. https://elibrary.ru/contents.asp?id=33303032.
Krivets SA, Kerchev IA (2011) Polygraphus proximus Blandf. is a new dangerous pest of coniferous forests in Tomsk oblast. Interexpo GEO-Siberia 3: 211–215.
Krivets SA, Kerchev IA, Bisirova EM, Pashenova NV, Demidko DA, Petko VM, Baranchikov YN (2015a) Ussuriiskii poligraf v lesakh Sibiri. [Four-Eyed Fir Bark Beetle in Siberian Forests]. UMIUM, Tomsk. [Venäjäksi].
Krivets SA, Kerchev IA, Bisirova EM, Demidko DA, Petko VM, Baranchikov YN (2015b) Distribution of four-eyed fir bark beetle Polygraphus proximus Blandf. (Coleoptera, Curculionidae: Scolytinae) in Siberia. Proceedings of the Forest Technical Academy 211: 33–45.
Krivets SA, Bisirova EM, Kerchev IA, Pats EN, Chernova NA (2015c) Transformation of taiga ecosystems in the Western Siberian invasion focus of four-eyed fir bark beetle Polygraphus proximus Blandford (Coleoptera: Curculionidae, Scolytinae). Russ J Biol Invasions 6: 94–108. https://doi.org/10.1134/S2075111715020058.
Krivosheina MG, Krivosheina NP, Kerchev IA (2018) Flies (Diptera) as associates of Polygraphus proximus Blandford 1894 (Coleoptera, Curculionidae) over the territory of Siberia and the Far East of Russia. Zool Zhurnal 97: 23–31. https://doi.org/10.7868/S0044513418010038.
Kryukov VYu, Yaroslavtseva ON, Elisaphenko EA, Mitkovets PV, Lednev GR, Duisembekov BA, Zakian SM, Glupov VV (2012) Change in the temperature preferences of Beauveria bassiana sensu lato isolates in the latitude gradient of Siberia and Kazakhstan. Microbiology 81: 453–459. https://doi.org/10.1134/S002626171204011X.
Loerch CR, Cameron EA (1983a) Determination of larval instars of the bronze birch borer, Agrilus anxius (Coleoptera, Buprestidae). Ann Entomol Soc Am 76: 948–952. https://doi.org/10.1093/aesa/76.6.948.
Loerch CR, Cameron EA (1983b) Natural enemies of immature stages of the bronze birch borer, Agrilus anxius (Coleoptera: Buprestidae), in Pennsylvania. Environ Entomol 12: 1798–1801. https://doi.org/10.1093/ee/12.6.1798.
Loerch CR, Cameron EA (1984) Within-tree distributions and seasonality of immature stages of the bronze birch borer, Agrilus anxius (Coleoptera: Buprestidae). Can Entomol 116: 147–152. https://doi.org/10.4039/Ent116147-2.
Mandelshtam, M.Yu. ja Popovichev, B.G. 2000: an annotated list of bark beetles (Coleoptera, Scolytidae) in Leningrad province. Ėntomologicheskoe Obozrenie 79: 599–618.
Marini L, Økland B, Jönsson AM, Bentz B, Carroll A, Forster B, Grégoire J-C, Hurling R, Nageleisen LM, Netherer S, Ravn HP, Weed A, Schroeder M (2017). Climate drivers of bark beetle outbreak dynamics in Norway spruce forests. Ecography 40: 1426–1435. https://doi.org/10.1111/ecog.02769.
Masuya H, Yamaoka Y, Wingfield MJ (2013) Ophiostomatoid fungi and their associations with bark beetles in Japan. Julkaisussa: Seifert KA, de Beer ZW, Wingfield MJ (toim) The ophiostomatoid fungi: expanding frontiers. CBS Biodiversity Ser. 12, CBS-KNAW Fungal Biodiversity Centre, s. 77–89.
Meng ZJ, Yan SC, Yang CP, Jin H, Hu XO (2011) Behavioural responses of Dendrolimus superans and Anastatus japonicus to chemical defences induced by application of jasmonic acid on larch seedlings. Scand J For Res 26: 53–60. https://doi.org/10.1080/02827581.2010.533689.
Mikkola K, Ståhls G (2008) Morphological and molecular taxonomy of Dendrolimus sibiricus Chetverikov stat.rev. and allied lappet moths (Lepidoptera:Lasiocampidae), with description of a new species. Entomol Fenn 19: 65–85. https://doi.org/10.33338/ef.84417.
Millar CI, Stephenson NL (2015) Temperate forest health in an era of emerging megadisturbance. Science 349: 823–826. https://doi.org/10.1126/science.aaa9933.
Miller RO, Bloese PD, Hanover JW, Haack RA (1991) Paper birch and European white birch vary in growth and resistance to bronze birch borer. Journal of the American Society for Horticultural Science 116: 580–584. https://doi.org/10.21273/JASHS.116.3.580.
Morewood WD, Hoover K, Neiner PR, McNeil JR, Sellmer JC (2004) Host tree resistance against the polyphagous wood-boring beetle Anoplophora glabripennis. Entomologia Experimentalis et Applicata 110: 79–86. https://doi.org/10.1111/j.0013-8703.2004.00120.x.
Muilenburg VL, Herms DA (2012) A review of bronze birch borer (Coleoptera: Buprestidae) life history, ecology, and management. Environ Entomol 41: 1372–1385. https://doi.org/10.1603/EN12238.
Muilenburg VL, Phelan PL, Bonello P, Herms DA (2011). Inter- and intra-specific variation in stem phloem phenolics of paper birch (Betula papyrifera) and European white birch (Betula pendula). J Chem Ecol 37: 1193–1202. https://doi.org/10.1007/s10886-011-0028-z.
Muilenburg VL, Phelan PL, Bonello P, Loess PF, Herms, DA (2013). Characterization of wound responses of stems of paper birch (Betula papyrifera) and European white birch (Betula pendula). Trees 27: 851–863. https://doi.org/10.1007/s00468-013-0839-3.
Musolin DL, Kirichenko NI, Karpun NN, Aksenenko EV, Golub VB, Kerchev IA, Mandelshtam MY, Vasaitis R, Volkovitsh MG, Zhuravleva EN, Selikhovkin AV (2022) Invasive insect pests of forests and urban trees in Russia: origin, pathways, damage, and management. Forests 13, article id 521. https://doi.org/10.3390/f13040521.
Möykkynen T, Pukkala T (2014) Modelling of the spread of a potential invasive pest, the Siberian moth (Dendrolimus sibiricus) in Europe. For Ecosyst 1, article id 10. https://doi.org/10.1186/s40663-014-0010-7.
Nardi D, Jactel H, Pagot E, Samalens JC, Marini L (2022) Drought and stand susceptibility to attacks by the European spruce bark beetle: a remote sensing approach. Agricultural and Forest Entomology 1–11. https://doi.org/10.1111/afe.12536.
Nielsen DG, Muilenburg VL, Herms DA (2011) Interspecific variation in resistance of Asian, European, and North American birches (Betula spp.) to bronze birch borer (Coleoptera: Buprestidae). Environ Entomol 40: 648–653. https://doi.org/10.1603/EN10227.
Nobuchi A (1966) Bark-beetles injurious to pine in Japan. Bull Govern For Exp Stat 185: 1–50. [Japaniksi, tiivistelmä englanniksi].
Ohtaka N, Masuya H, Yamaoka Y, Kaneko S (2006) Two new Ophiostoma species lacking conidial states isolated from bark beetles and bark beetle-infested Abies species in Japan. Can J Bot 84: 282–293. https://doi.org/10.1139/b05-164.
Pashenova NV, Kononov AV, Ustyantsev KV, Blinov AG, Pertsovaya AA, Baranchikov YN (2018) Ophiostomatoid fungi associated with the four-eyed fir bark beetle on the territory of Russia. Russ J Biol Invasions 9: 63–74. https://doi.org/10.1134/S2075111718010137.
Pavlov IN, Litovka YA, Golubev DV, Astapenko SA, Chromogin PV (2018). New outbreak of Dendrolimus sibiricus Tschetv. in Siberia (2012–2017): monitoring, modeling and biological control. Contemp Probl Ecol 11: 406–419. https://doi.org/10.1134/S1995425518040054.
Pavlov IN, Litovka YA, Golubev DV, Astapenko SA, Chromogin PV, Usoltseva YV, Makolova PV, Petrenko SM (2020) Mass reproduction of Polygraphus proximus Blandford in fir forests of Siberia infected with root and stem pathogens: monitoring, patterns, and biological control. Contemp Probl Ecol 13: 71–84. https://doi.org/10.1134/S1995425520010060.
Peterson W (1904) Über Dendrolimus pini und D. segregatus. Bull Russian Ent Rev 4.
Rozhkov AS (1963) The Siberian Moth. AS USSR Press, U.S.S.R. [Venäjäksi].
Rutledge CE (2020). Preliminary studies on using emerald ash borer (Coleoptera: Buprestidae) monitoring tools for bronze birch borer (Coleoptera: Buprestidae) detection and management. Forestry 93: 297–304. https://doi.org/10.1093/forestry/cpz012.
Rutledge CE, Keena MA (2012) Mating frequency and fecundity in the emerald ash borer Agrilus planipennis (Coleoptera: Buprestidae). Ann Ent Soc Am 105: 66–72. https://doi.org/10.1603/AN11037.
Sakai AK, Allendorf FW, Holt JS, Lodge DM, Molofsky J, With KA, Baughman S, Cabin RJ, Cohen JE, Ellstrand NC, McCauley DE, O’Neil P, Parker IM, Thompson JN, Weller SG (2001) The population biology of invasive species. Ann Rev Ecol Syst 32: 305–332. https://doi.org/10.1146/annurev.ecolsys.32.081501.114037.
Seidl R, Klonner G, Rammer W, Essl F, Moreno A, Neumann M, Dullinger S (2018) Invasive alien pests threaten the carbon stored in Europe’s forests. Nat Commun 9, article id 1626. https://doi.org/10.1038/s41467-018-04096-w.
Selikhovkin AV, Popovichev BG, Mandelshtam MY, Vasaitis R, Musolin DL (2017) The frontline of invasion: the current northern limit of the invasive range of emerald ash borer, Agrilus planipennis Fairmaire (Coleoptera: Buprestidae), in European Russia. Baltic Forestry 23: 309–315. https://www.balticforestry.mi.lt/bf/PDF_Articles/2017-23%5B1%5D/Baltic%20Forestry%202017.1_309-315.pdf. Viitattu 30.7.2020.
Shabalina OM, Bezkorovaynaya IN, Baranchikov YuN (2017) Changes of phytocenosis understories of fir forests in the breeding grounds of four-eyed fir bark beetle (Polygraphus Proximus Blandf.) in the Krasnoyarsk territory. Lesnoy Zhurnal – Forestry Journal 2: 67–84. https://doi.org/10.17238/issn0536-1036.2017.2.67.
Shimizu A, Tanaka R, Akiba M, Masuya H, Iwata R, Fukuda K, Kanzaki N (2013) Nematodes associated with Dryocoetes uniseriatus (Coleoptera: Scolytidae). Environ Entomol 4: 79–88. https://doi.org/10.1603/EN12165.
Siitonen J (1990). Potential forest pest beetles conveyed to Finland on timber imported from the Soviet Union. Silva Fenn 24: 315–321. https://doi.org/10.14214/sf.a15585.
Silk PJ, Ryall KL, Grant G, Roscoe LE, Mayo P, Williams M, LeClair G, Kimoto T, Williams D, Rutledge C (2020) Tree girdling and host tree volatiles provides a useful trap for bronze birch borer Agrilus anxius Gory (Coleoptera: Buprestidae). Forestry 93: 265–272. https://doi.org/10.1093/forestry/cpz021.
Stephens PA, Sutherland WJ, Freckleton RP (1999) What is the Allee effect? Oikos 87: 185–190. https://doi.org/10.2307/3547011.
Takagi E, Masaki D, Kanai R, Sato M, Iguchi K (2018) Mass mortality of Abies veitchii caused by Polygraphus proximus associated with tree trunk diameter in Japan. For Ecol Manag 428: 14–19. https://doi.org/10.1016/j.foreco.2018.06.030.
Tkacz BM, Schmitz RF (1985) Association of an endemic mountain pine beetle population with lodgepole pine infected by Armillaria root disease in Utah, Washington, DC. USDA Report 353.
Tokuda M, Shoubu M, Yamaguchi D, Yukawa J (2008) Defoliation and dieback of Abies firma (Pinaceae) trees caused by Parendaeus abietinus (Coleoptera: Curculionidae) and Polygraphus proximus (Coleoptera: Scolytidae) on Mount Unzen, Japan. Appl Entomol Zool 43: 1–10. https://doi.org/10.1303/aez.2008.1.
Triapitsyn SV, Petrice TR, Gates MW, Bauer LS (2015) Two new species of Oobius Trjapitzin (Hymenoptera, Encyrtidae) egg parasitoids of Agrilus spp. (Coleoptera, Buprestidae) from the USA, including a key and taxonomic notes on other congeneric Nearctic taxa. ZooKeys 498: 29–50. https://doi.org/10.3897/zookeys.498.9357.
Uotila A, Kasanen R, Heliövaara K (2020) Metsätuhot. Toinen painos. Metsäkustannus Oy.
Vanhanen H, Veteli P, Niemelä P (2008) Potential distribution ranges in Europe for Ips hauseri, Ips subelongatus and Scolytus morawitzi, a CLIMEX analysis. EPPO Bulletin 38: 249–258. https://doi.org/10.1111/j.1365-2338.2008.01212.x.
Vinokurov NN, Isaev AP (2002) The Siberian moth in Yakutia. Sci Technol Yakutia 3: 53–56. [Venäjäksi].
Yamaoka Y, Masuya H, Ohtaka N, Goto H, Kaneko S, Abe JP (2004a) Three new Ophiostoma species with Pesotum anamorphs associated with bark beetles infesting Abies species in Nikko, Japan. Mycoscience 45: 277–286. https://doi.org/10.1007/S10267-004-0179-7.
Yamaoka Y, Masuya H, Ohtaka N, Goto H, Kaneko S, Kuroda Y (2004b) Ophiostoma species associated with bark beetles infesting three Abies species in Nikko, Japan. J For Res 9: 67–74. https://doi.org/10.1007/s10310-003-0056-9.
Zimmermann G (2007) Review on safety of the entomopathogenic fungi Beauveria bassiana and Beauveria brongniartii. Biocontrol Sci Technol 17: 553–596. https://doi.org/10.1080/09583150701309006.
Økland B, Haack RA, Wilhelmsen G (2012) Detection probability of forest pests in current inspection protocols – a case study of the bronze birch borer. Scand J For Res 27: 285–297. https://doi.org/10.1080/02827581.2011.632782.
125 viitettä.