Saarnen merkittävimmät uhkatekijät: saarnensurma, saarnenjalosoukko ja saarnipistiäinen
Hantula J., Koivula M., Nuorteva H., Ylioja T. (2022). Saarnen merkittävimmät uhkatekijät: saarnensurma, saarnenjalosoukko ja saarnipistiäinen. Metsätieteen aikakauskirja vuosikerta 2022 artikkeli 10728. https://doi.org/10.14214/ma.10728
Tiivistelmä
Ash (Fraxinus excelsior L.) is a relatively rare tree species in Finland, as it is common only in the southernmost part of the country although its distribution area ranges up to Oulu region. Finnish ash trees were free of dangerous pests and pathogens until 1990´s when an ascomycete Hymenoscyptus fraxineus (T. Kowalski) Baral, Queloz & Hosoya causing ash decline was introduced to Europe and changed the situation. Thereafter also hymenopteran Tomosthetus nigritus Fabricius has become more common in Finland due to an unknown reason and can now be considered harmful on the health of ash trees. In addition, the emerald ash borer, Agrilus planipennis Fairmaire, that has caused considerable damage especially in North America, has become a threat to ash trees as it is spreading in Russia towards Finland. In this review we will describe the biology and control possibilities of these three organisms and their distribution history in Finland and elsewhere.
Avainsanat
Agrilus planipennis;
Hymenoscyphus fraxineus;
Tomostethus nigritus;
metsäpatologia;
tuhohyönteiset;
vieraslajit
-
Hantula,
Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki
 https://orcid.org/0000-0002-1016-0636
Sähköposti
jarkko.hantula@luke.fi
https://orcid.org/0000-0002-1016-0636
Sähköposti
jarkko.hantula@luke.fi

-
Koivula,
Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki
 https://orcid.org/0000-0001-6415-4904
Sähköposti
matti.koivula@luke.fi
https://orcid.org/0000-0001-6415-4904
Sähköposti
matti.koivula@luke.fi
-
Nuorteva,
Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki
 https://orcid.org/0000-0002-8211-9843
Sähköposti
heikki.nuorteva@luke.fi
https://orcid.org/0000-0002-8211-9843
Sähköposti
heikki.nuorteva@luke.fi
-
Ylioja,
Luonnonvarakeskus (Luke), Luonnonvarat, Helsinki
 https://orcid.org/0000-0002-8840-7504
Sähköposti
tiina.ylioja@luke.fi
https://orcid.org/0000-0002-8840-7504
Sähköposti
tiina.ylioja@luke.fi
Vastaanotettu 14.3.2022 Hyväksytty 31.8.2022 Julkaistu 21.11.2022
Katselukerrat 129262
Saatavilla https://doi.org/10.14214/ma.10728 | Lataa PDF

 |
1 Johdanto
Vieraslajit ovat eliölajeja, jotka levittäytyvät uusille alueille ihmisen toimien seurauksena; tulokaslajit taas levittäytyvät omin avuin. Uudelle alueelle saapunut vieras- tai tulokaslaji uhkaa potentiaalisesti alueen alkuperäislajistoa ja sillä voi olla myös merkittäviä taloudellisia tai yhteiskunnallisia vaikutuksia. Puustotuholaiset ovat hyvä esimerkki tällaisista vaikutuksista: kaupunkipuiden kuolleisuus voi jopa lisätä ihmisten kuolleisuutta lisääntyneen stressin ja hengitysilman laadun heikkenemisen myötä (Donovan ym. 2013).
Vierasperäiset tuhonaiheuttajat leviävät yleisimmin elävien kasvien kaupan sekä erilaisten kasvimateriaalien, kuten pyöreän puun, hakkeen tai pakkausmateriaalien mukana (Roques ym. 2009; Santini ym. 2013). Myös jotkin Suomessa vielä tapaamattomat lajit saattavat saapua maahamme idästä tavaratuonnin mukana. Viime vuosien dramaattisimpia esimerkkejä on 2015 Kiinasta puisissa pakkauslaatikoissa Suomeen saapunut ja varastoalueen lähilehtipuihin iskeytynyt aasianrunkojäärä Anoplophora glabripennis Motschulsky, jonka esiintymän Ruokavirasto sai nopeasti määriteltyä ja kuoriaiset hävitettyä (Ruokavirasto 2021).
Euroopan unionin vieraslajiasetus (EU N:o 1143/2014) edellyttää jäsenvaltioilta tehokkaita toimia vieraslajien hävittämiseksi tai leviämisen estämiseksi. Suomessa kansallinen vieraslajistrategia tähtää tähän (Maa- ja metsätalousministeriö 2012), ja laki vieraslajeista aiheutuvien riskien hallinnasta (1709/2015) astui voimaan vuoden 2016 alussa. Lain täytäntöön panemiseksi Suomen ympäristökeskus ja Luonnonvarakeskus ovat laatineet useita hallintasuunnitelmia, viimeisimmän vuonna 2021 (Maa- ja metsätalousministeriö 2021), mutta koska lajien levinneisyydet tai levittäytyminen eivät noudata hallintorajoja, on kansainvälinen yhteistyö ensiarvoisen tärkeää vieraslajien leviämisen estämisessä.
Vieraslajit voivat Suomessa ylittää EU:n ja Venäjän rajan. Niiden torjunnan kannalta olisi kaikinpuolinen etu, mikäli tulkinta lajin haitallisuudesta olisi rajan molemmin puolin samanlainen, seuranta olisi järjestetty ja tehokkaat torjuntatoimet olisi määritelty lailla. Venäjän vieraslajipolitiikkaa määrittelee useita lakeja. Esimerkiksi tasavallalle uusien lajien maahantuonti, siirrot tai kasvattaminen ovat luvanvaraisia. Venäjällä on tunnistettu joukko karanteenilajeja, mukana puustotuholaisia, ja parhaillaan maassa päivitetään karanteenilajeja koskevaa lainsäädäntöä. Venäjä kuuluu Euroopan ja Välimeren maiden kasvinsuojelujärjestö EPPO:on, joka laatii mm. riskiarviointeja, standardeja ja ohjeistuksia tavoitteenaan yhteistyö- ja kasvinsuojelutoimien yhdenmukaistaminen.
Ilmaston lämpeneminen voi parantaa vieras- ja tulokaslajien mahdollisuuksia asettua ja vakiintua uusille alueille ajan kuluessa. Lämpötilan ja sateisuuden muutokset voivat suosia uusia tuholaisia. Myös puihin kohdistuvat muut stressitekijät, kuten ympäristön muutokset, muut taudit ja hyönteiset, voivat altistaa puita vieraslajeille. Myös kotoperäinen lajisto voi runsastua aiempaa enemmän ja aiheuttaa enenevässä määrin puustotuhoja.
Saarni eli lehtosaarni (Fraxinus excelsior L.) on kansainvälisesti merkittävä sahatavaran lähde ja yleisesti käytetty sisustus- ja huonekalupuu. Suomessa saarnea tavataan luontaisesti etupäässä eteläisimmän Suomen tammivyöhykkeellä, ja laji on nykyisin yleinen enää lounaissaaristossa sekä Ahvenanmaalla, sillä sen luontaisia kasvupaikkoja on raivattu maatalousmaaksi. Luonnontieteellisen keskusmuseon kasviatlaksessa on hajahavaintoja länsipainotteisesti Oulun korkeudelle saakka. Saarnen esiintymisen eteläisyys johtuu sen heikosta kylmänsiedosta: juurivyöhykkeen lämpötila ei saisi laskea alle viiden pakkasasteen (Väre ja Kiuru 2015). Suomessa saarnea ja saman suvun lajeja tavataan myös arvokkaina ja harvinaisina puistopuina.
Saarnilla on satoja seuralaislajeja, joista osa voi olla kotimaiselle lehtosaarnelle haitallisia. Tässä artikkelissa käsitellään niistä kolmea. Kaksi niistä on maailmalla laajoja puustotuhoja aiheuttaneita vieraslajeja: saarnensurma (Hymenoscyphus fraxineus (T. Kowalski) Baral, Queloz & Hosoya; Helotiales, Helotiaceae) ja jalokuoriaisiin kuuluva saarnenjalosoukko (Agrilus planipennis Fairmaire; Coleoptera, Buprestidae). Kolmas laji – lehtipistiäisiin kuuluva saarnipistiäinen (Tomostethus nigritus Fabricius; Hymenoptera, Tenthredinidae) – on harvinainen esimerkki lajista, joka on ollut pirstaloituneen esiintymisensä vuoksi vaarantuneeksi luokiteltu, mutta josta on kehittynyt vuosikymmenessä Etelä-Suomen kulttuuriympäristöissä huomiota ja kansalaisten huolta herättävä lähestulkoon puisto- ja pihapuiden tuhohyönteiseksi luokiteltava laji.
Tässä katsauksessa kuvataan saarnensurman, saarnenjalosoukon ja saarnipistiäisen biologiaa ja torjuntamahdollisuuksia sekä niiden esiintymishistoriaa Suomessa ja muualla.
2 Aineisto ja menetelmät
Katsauksen aineisto koostuu saarnensurmaan, saarnenjalosoukkoon ja saarnipistiäiseen liittyvistä tieteellisistä ja muista artikkeleista sekä kirjoittajien omista sekä heidän kansainvälisten kollegojensa (Jan Stenlid, Erik Kjær ja Marina Orlova-Bienkowskaja) välittämistä havainnoista. Kirjallisuushaut tehtiin joulukuussa 2021 käyttäen Google Scholar ja ISI Web of Science -palveluita hyödyntäen hakusanoina katsauksessa käsiteltyjen lajien nykyisiä ja entisiä tieteellisiä nimiä sekä lisämääreinä tarkentavia sanoja “ash decline”, “control”, “diversity”, “life cycle”, “mycovirus” ja “symptoms”. Näiden lisäksi hyödynnettiin etenkin aiheen yleisen viitekehyksen osalta kirjoittajien jo aiemmin tiedossa olleita oleellisimmiksi tiedettyjä kirjallisuustietoja. Hakutoimien tuottamista kirjallisuusviitteistä valittiin kunkin aiheen suhteen informatiivisimmat julkaisut pyrkimättä koko kirjallisuuden suhteen täydelliseen kattavuuteen.
3 Saarnensurma
3.1 Invasiivinen vieraspatogeeni Euroopassa
Saarnensurma on 1990-luvulta lähtien tuhonnut eurooppalaisia saarnimetsiä. Ensimmäiset havainnot tästä metsätaudista ovat Puolasta, mistä se levisi nopeasti Euroopan läpi aina Brittein saarille asti (Przybyl 2002; Kowalski ja Holdenrieder 2009; Timmermann ym. 2011; Pautasso ym. 2013). Syynä tautiin on Hymenoscyphus fraxineus -niminen suvullinen kotelosieni (suvuton muoto Chalara fraxinea T. Kowalski) (Kowalski ym. 2006; Queloz ym. 2011; Baral ym. 2014), joka on alkujaan itäaasialaisessa mantsuriansaarnessa (Fraxinus mandshurica Rupr.) elävä varsin harmiton sieni (Zhao ym. 2013; Gross ym. 2014; Han ym. 2014; Cleary ym. 2016).
Saarnen lisäksi H. fraxineus on syrjäyttämässä Euroopasta itselleen lähisukuisen Hymenoscyphus albidus (Gillet) W. Phillips -nimisen saarnen endofyytti- eli lymysienen (McKinney ym. 2012). Tämä johtuu ilmeisesti siitä, että lajit kilpailevat samoista ekologisista resursseista, joten ajan myötä kilpailussa voimakkaampi laji hävittää heikomman, kuten on aiemmin käynyt esimerkiksi Ophiostoma novo-ulmi Brasier -lajin syrjäytettyä hollanninjalavataudin ensimmäisen aiheuttajan Ophiostoma ulmin (Buisman) Nannf. (Brasier 1991) Euroopasta. Hymenoscyphus-lajien osalta ei kuitenkaan ole havaittu samanlaisia risteymiä ja lajien välistä geenien siirtymistä kuin aiemmin tapahtui Ophiostoma-lajien välillä (Hessenauer ym. 2020).
3.2 Saarnensurma metsätautina
Saarnensurmasieni leviää kesäkuusta syksyyn tuulen mukana kulkeutuvilla koteloitiöillä, joita tuottavat maahan edellisenä kesänä ja syksyllä pudonneisiin versojen osiin kasvavat itiöemät (Kuva 1). Saarnen lehdille laskeuduttuaan itiöistä kasvava rihmasto tunkeutuu kutikulan ja epidermin läpi sekä edelleen lehtiruoteihin, oksiin ja versoihin. Tämän seurauksena kasvin putkilosolut tukkeutuvat aiheuttaen puun vähittäisen näivettymisen (Gross ym. 2014). Suvullisten koteloitiöiden lisäksi tartuntoja saattavat aiheuttaa myös kasvien pinnalla tai karikkeessa suvuttomasti kehittyvät kuromaitiöt (Fones ym. 2016), joten sienen lisääntymisbiologia on monimuotoinen ja siten sen evolutiivista potentiaalia muuttuviin olosuhteisiin voidaan pitää korkeana. Tämä saattaa vaikeuttaa torjuntatoimien kehittämistä saarnensurmaa vastaan (McDonald ja Linde 1993).

Kuva 1. Saarnensurmasienen suvullisia itiöemiä. (Kuva: Michael Müller).
Saarnensurman ensimmäisiä ulkoisia oireita ovat taimissa kesän aikana nuukahtavat latvat ja lehdet sekä suurempien puiden latvuksista törröttävät yksittäiset lehdettömät oksat. Taudin aikana saarnen lehtiin ja lehtiruoteihin muodostuu tummia kuoliolaikkuja, nuorten puiden runkoihin ja pieniin oksiin kynnenpainallusta muistuttavia kuoririkkoja sekä isompien puiden runkoihin ja oksiin selviä koroja. Taudin edetessä oksia kuolee vuosittain, jolloin puut kasvattavat niiden tilalle suoraan rungosta esille pistäviä vesioksia. Ne säilyvät muita oksia pidempään elävinä ja tuottavat sairastuneelle puulle tyypillisen ulkonäön, jossa latvuksen vihreää sisäosaa ympäröivät kuolleet oksat (Kuva 2a).

Kuva 2. Saarni, joka toipui (b) vuonna 2009 näkyneistä tyypillisistä saarnensurman oireista (a) vuoteen vuoteen 2019 mennessä. (Kuvat: Jarkko Hantula).
Saarnensurmaa ei ole tällä hetkellä mahdollista torjua saarnilehdoissa. Sen sijaan puistomaisissa olosuhteissa syksyisen lehtikarikkeen haravointi on todennäköisesti järkevää, koska se vähentää puihin kohdistuvaa itiöpainetta. Vähäisistä oireista kärsivien saarnien poistaminen ei ole suositeltavaa, koska puut saattavat toipua tartunnasta. Siten poistetuksi saattaisi tulla myös sienitartuntaa perinnöllisesti kestäviä puuyksilöitä tulevaisuuden kannalta tärkeine geeneineen.
3.3 Saarnensurmaan liittyvää genetiikkaa
Saarnensurman eurooppalaisessa populaatiossa esiintyy melko runsaasti perinnöllistä vaihtelua (Rytkönen ym. 2011; Bengtsson ym. 2012; Gross ym. 2014), joskin lajin muuntelu on sen lähtöalueilla oleellisesti korkeampaa (Sønstebø ym. 2017). Vaihtelun merkitystä sienen taudinaiheuttamiskyvylle ei tunneta. Sen pohjalta on kuitenkin esitetty hypoteesi, jonka mukaan patogeeni olisi levinnyt Eurooppaan yhdellä kerralla, mutta kahtena yksilönä. Hypoteesi perustuu siihen, että kussakin geenilokuksessa esiintyy pääsääntöisesti ainoastaan kaksi alleelia (Gross ym. 2014). Se on yhteensopiva myös sen kanssa, että sienen mitokondrioissa esiintyy yleisesti viruksia, jotka jakautuvat kahteen eri geneettiseen ryhmään (Schoebel ym. 2017).
Monet meillä eksoottiset saarnilajit ovat varsin kestäviä saarnensurmaa vastaan (Gross ym. 2014; Kirisits ja Scwanda 2015; Drenkhan ym. 2017), mutta Suomessa esiintyvä saarni on sille varsin altis. Kuitenkin myös sillä esiintyy perinnöllistä kestävyyttä tautia vastaan (Kjær ym. 2012; Wohlmuth ym. 2018; Stocks ym. 2019). Tämän seurauksena sienitauti ei tule hävittämään eurooppalaista saarnea kokonaan, koska perinnöllisesti kestävät puut muodostavat perustan toipuvalle saarnikannalle. Tätä kehitystä voidaan nopeuttaa systemaattisella metsänjalostusprosessilla, jollainen on jo aloitettu esimerkiksi Tanskassa (Erik Kjær, henkilökohtainen tiedonanto), joskin edellä mainittu tuhonaiheuttajan korkea evolutiivinen potentiaali lisää tautiresistenssin kehittymisen riskiä (McDonald ja Linde 1993).
3.4 Saarnensurman mikrobiologiaa
Saarnensurman sairastuttamien puiden juuristoissa ja tyvellä esiintyy usein mesisientä. Se ilmaantuu saarnensurmaisiin puihin sekundaarisena tuhonaiheuttajana ja heikentää niiden terveyttä entisestään (Lygis ym. 2005; Madsen ym. 2021). Toisaalta monien saarnen lymysienten ja -bakteereiden on todettu esiintyvän yleisemmin terveissä kuin sairastuneissa saarnissa (Becker ym. 2020; Ulrich 2020), mikä viittaa niiden mahdolliseen antagonistisuuteen patogeenia vastaan. Tämä saattaa tulevaisuudessa mahdollistaa biologisen torjuntakeinon kehittämisen saarnensurmaa vastaan. Sen sijaan virustartuntojen ei ole havaittu aiheuttavan H. fraxineus -lajille hypovirulenssia eli taudinaiheuttamiskyvyn alenemista (Schoebel ym. 2017), joten niiden hyödyntäminen kastanjansurmavirusten tapaan taudin torjunnassa ei ole mahdollista (Anagnostakis 1982).
3.5 Saarnensurma Suomessa
Saarnensurman esiintyminen Suomessa (Kuva 3) varmistettiin ensimmäisen kerran vuonna 2007 kerätyistä näytteistä, mutta sieni on esiintynyt Ahvenanmaalla jo ainakin vuodesta 2000 alkaen (Lilja ym. 2011; Rytkönen ym. 2011; Jan Stenlid, henkilökohtainen tiedonanto). Kuluneiden kahden vuosikymmenen aikana saarnensurma on tuhonnut useita saarnilehtoja mukaan lukien joitakin geenireservimetsiä, joihin syntyvien kantovesojen tulevaisuutta uhkaavat sekä saarnensurma että sairastuneiden puiden juuristoihin usein leviävä mesisieni (Lygis ym. 2005). Kaiken kaikkiaan tuho näyttäisi Suomessa jäävän kuitenkin selvästi vähäisemmäksi kuin monessa muussa Euroopan maassa (esim. Matisone ym. 2018). Tämä arvio ei kuitenkaan perustu mitattuun tietoon, koska Suomesta puuttuu saarnensurman systemaattinen seuranta ja puulaji on liian harvinainen, jotta valtakunnan metsien inventointi tuottaisi tuhon määrästä tarkkaa tietoa.
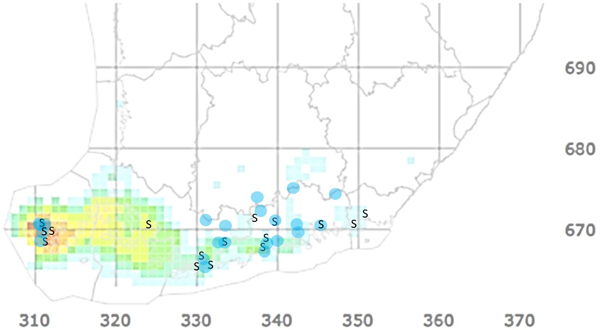
Muutamia saarnia tai saarnimetsiä on Suomessa seurattu systemaattisesti, ja niiden perusteella taudin eteneminen ei ole tasaista, vaan oireiden asteen on yksittäisissä puissa havaittu vaihtelevan vuodesta toiseen. Lisäksi näissä seurannoissa on dokumentoitu yksi tapaus, jossa suurikokoinen tyypillisistä saarnensurman oireista kärsinyt ja pahasti harsuuntunut saarni (Kuva 2a) palautui täysin terveen näköiseksi (Kuva 2b). Syytä puun toipumiseen ei tiedetä.
Suomalaisessa saarnessa esiintyvän perinnöllisen kestävyyden selvittämiseksi on Raaseporin Solböleen perustettu koemetsikkö. Siihen on istutettu taimia, jotka on kasvatettu useiden saarnensurman runtelemien metsiköiden terveistä ja sairaista saarniyksilöistä kerätyistä siemenistä. Kyseessä on koeasetelma, jonka tavoitteena on selvittää, voidaanko saarniyksilön fenotyypistä päätellä sen jälkeläisen kestävyys saarnensurmaa vastaan. Jos tästä metsiköstä ajan myötä karsiutuvat joidenkin emopuiden – koetta perustettaessa käytetyn hypoteesin mukaisesti siis sairaiden puiden siemenestä kasvatetut – jälkeläiset pois, voidaan päätellä myös suomalaisen saarnialkuperän sisältävän geneettistä kestävyyttä tautia vastaan. Samalla metsikössä runsastuvat useista eri saarnikoista peräisin olevat saarnensurman kestävät emopuut, joiden voi olettaa risteytyessään tuottavan entistä kestävämpiä sekä perinnöllisesti monimuotoisia jälkeläisiä. Niitä voidaan aikanaan käyttää edelleen nopeuttamaan suomalaisen saarnialkuperän palauttamista taudin seurauksena kuoleviin saarnilehtoihin ja kaupunkien puistoihin.
4 Saarnenjalosoukko
4.1 Saarnenjalosoukon biologiaa
Kotoperäisillä alueillaan Kiinassa saarnenjalosoukon (Kuva 4) elinkierto on 1–2 vuotta riippuen ilmastosta ja isäntäpuiden kunnosta (Liu ym. 2007; Wei ym. 2007; Wang ym. 2010). Aikuiset munivat touko–kesäkuussa, ja munat kuoriutuvat reilun kahden viikon kuluttua; kuoriutumista seuraa neljä toukkavaihetta, joista pääosin viimeistä vaihetta edustavat toukat siirtyvät marraskuun alkuun mennessä talvehtimaan puun mantokerrokseen kaivamiinsa talvehtimiskammioihin (Wang ym. 2010). Koteloituminen on huhti–toukokuussa, ja aikuiset kuoriutuvat toukokuussa 250–270 astepäivän tienoilla (perustana +10 °C; Herms 2004; Brown-Rytlewski ja Wilson 2005; Herms ja McCullough 2014). Aikuiset elävät vain kolmisen viikkoa, mutta eri aikoina kuoriutuvien yksilöiden ansiosta aktiivinen kausi ulottuu heinäkuuhun; päälentokausi on toukokuun puolivälin paikkeilla (Wang ym. 2010).

Kuva 4. (a) Saarnenjalosoukko, aikuinen (Kuva: David Cappaert, Bugwood.org, CC BY NC 3.0). (b) Saarnenjalosoukon vaivaama saarni, Vjazma, Smolenskin oblasti, Venäjä (Kuva: Marina Orlova-Bienkowskaja). (c) Saarnenjalosoukon toukkakäytäviä saarnella, Zelenograd, Moskovan oblasti (hallintoalue), Venäjä (Kuva: Marina Orlova-Bienkowskaja). (d) Saarnenjalosoukon ulostulokäytäviä saarnella, Orel, Orlovskin alue, Venäjä. (Kuva: Marina Orlova-Bienkowskaja).
Saarnenjalosoukon isäntäpuut Aasiassa ovat lähinnä erilaisia saarnia, esimerkiksi mantsurian- ja samettisaarni (Fraxinus velutina) sekä puistopuiksi istutetut korean- (Fraxinus chinensis Roxb.) ja punasaarni (Fraxinus pennsylvanica Marshall). Kuoriaista ei näillä seuduilla pidetä merkittävänä puustotuholaisena (Liu ym. 2007; Rebek ym. 2008; Wang ym. 2010). Aikuiset syövät saarnen lehtiä, kun taas toukat kaivavat käytäviä mantokerrokseen ja pintapuuhun.
Saarnenjalosoukon levittäytymiskykyä on tutkittu mm. lentomyllyillä (flight mill) ja kuoriutumispuun etäisyysfunktioilla. Keskimäärin aikuinen kykenee vuorokaudessa lentämään lähes kaksi kilometriä (Taylor ym. 2010), mutta tämä riippuu lämpötilasta, optimin ollessa noin 28 °C, sekä ilman kosteudesta, kuivemman sään ollessa lentämisen kannalta parempi (Fahrner ym. 2015). Jalosoukot munivat pääasiassa alle sadan metrin päässä kuoriutumispuusta, vain kymmenesosa kauempana (Mercader ym. 2009).
Saarnenjalosoukon levinneisyyttä rajoittaa erityisesti talviajan lämpötila. Kylmien jaksojen yli toukat selviytyvät kerryttämällä elimistöönsä glyserolia ja muita jäätymistä estäviä yhdisteitä (Crosthwaite ym. 2011). Yhtään paikallispopulaatioita ei ole tavattu alueilta, joilla lämpötila laskee alhaisemmaksi kuin –34 °C (Orlova-Bienkowskaja ja Bienkowski 2020). Näin ollen esimerkiksi eteläinen Suomi olisi tästä näkökulmasta kuoriaisen asutettavissa.
Loispistiäiset voivat merkittävällä tavalla rajoittaa saarnenjalosoukon kannan kasvua. Esimerkiksi Changcunissa, Kiinassa loispistiäisten havaittiin vähentäneen saarnenjalosoukon kannantiheyttä yli 70 % punasaarnilla (Wang ym. 2010). Eräät sikäläiset vaino-, hyppykiilu- ja hentokiilupistiäislajit (Spathius agrili Yang, Oobius agrili Zhang & Huang ja Tetrastichus planipennisi Yang) munivat saarnenjalosoukon muniin ja toukkiin läpi kuoriaisen toukkakauden, minkä mahdollistavat näiden loispistiäisten useat vuosittaiset sukupolvet; loisiminen voi saavuttaa jopa 40–60 %:n tason, joskin keskimäärin se jää alhaisemmaksi (Liu ym. 2007; Yang ym. 2010).
4.2 Saarnenjalosoukko vieraslajina
Saarnenjalosoukko kulkeutui Aasiasta 1990-luvulla Pohjois-Amerikkaan luultavasti tuontitavaran mukana (Bray ym. 2011; Herms ja McCullough 2014; Jennings ym. 2017). Seitsemän yhdysvaltalaisen ja 17 aasialaisen näytepaikan vertailussa pohjoisamerikkalaiset populaatiot olivat perinnöllisesti lähimpänä Kiinan Hebein ja Tianjinin maakuntien populaatioita (Bray ym. 2011). Vuonna 2017 lajin raportoitiin levittäytyneen 35:een Yhdysvaltain osavaltioon ja kolmeen Kanadan territorioon (Jennings ym. 2017) aiheuttaen kaikkialla eri saarnilajien joukkokuolemia (Herms ja McCullough 2014). Kuoriaisen asetuttua alueelle saarnet alkavat kuolla nopeasti kuolleisuuden kasvaessa vuosittain kolmisen prosenttia (Morin ym. 2017). Kaikkiaan arviot saarnenjalosoukon vuoksi kuolleista saarnista Yhdysvalloissa ja Venäjällä ovat epätarkkoja, mutta suuruusluokka lienee sadoissa miljoonissa puissa (esim. Orlova-Bienkowskaja ja Volkovitsh 2018). Luku kuulostaa korkealta, mutta yksin Yhdysvalloissa on arvioitu kasvavan noin kahdeksan miljardia saarnea, mikä tarkoittaisi tähän saakka enintään 10 %:n kuolleisuutta, toki saarnilajeittain ja maantieteellisesti vaihdellen.
Kuoriainen on jo noin 20 vuotta sitten asettunut Moskovan seudulle, missä ensimmäiset havainnot kirjattiin puistopuiksi istutetuilta punasaarnilta (Selikhovkin ym. 2017). Tämän seudun ja Kaakkois-Aasian väliltä ei ole kertynyt havaintoja saarnenjalosoukosta, ja myös saarnet ovat tällä välillä harvinaisia, joten todennäköisimpänä levittäytymistapana pidetään puisten pakkausmateriaalien mukana kulkeutumista (Marina Orlova-Bienkowskaja, kirj. ilm.). Oletettavasti samalla tapaa saapuneena laji havaittiin punasaarnella 2019 Ukrainassa (Drogvalenko ym. 2019). Suomea lähimmät havainnot tehtiin 2019–2020 reilu sata kilometriä itärajaltamme, Pietarista, joten riski sen levittäytymisestä Suomen rajan yli on todellinen (Volkovitsh ym. 2021). Saarnia kasvaa verraten tasaisesti kaakkoisrajalta lähtien maamme eteläisimmissä osissa, joskin idässä useimmiten yksinpuin (Kuva 3, Kasviatlas, luomus.fi).
Saarnenjalosoukon pitkän matkan levittäytyminen uusille alueille tapahtuu etupäässä taimien, käsittelemättömän puutavaran sekä pakkausmateriaalien, polttopuun ja puuhakkeen mukana (EPPO 2013). Saavuttuaan saarnirikkaalle seudulle laji kykenee levittäytymään omin avuin, mutta pidemmät matkat se leviää ilmeisesti kulkuneuvojen ja polttopuukuljetuksien mukana (Muirhead ym. 2006; Straw ym. 2013; Wang ym. 2014). Yhdysvalloissa laji on levittäytynyt 2,5–80 kilometriä vuodessa (Mercader ym. 2016), ja myös Venäjällä levittäytymisvauhti on ollut samanlaista, 30–41 kilometriä vuodessa, pääasiassa liikenneväylien varsia ja jokilaaksoja pitkin (Selikhovkin ym. 2017). Hiljattain Valenta ym. (2017) arvioivat lajin saavuttavan Keski-Euroopan 15–20 vuodessa, mutta tuoreet Pietarin havainnot (Volkovitsh ym. 2021) viittaavat siihen, että kyse voi pikemminkin olla muutamista vuosista.
4.3 Saarnenjalosoukko puustotuholaisena
Monen puutuholaisen epidemia edellyttää olosuhteita, jotka valmiiksi rasittavat isäntäpuita: laaja-alainen myrsky, pitkään jatkuva kuivuus, useat perättäiset kuumat kesät, sieni-infektio ja näiden erilaiset yhdistelmät ovat tällaisia. Saarnenjalosoukko ei ole poikkeus, vaan se iskee helpoimmin jo valmiiksi heikentyneisiin saarniin (esim. Jennings ym. 2015; Evans ym. 2020). Kuitenkin Yhdysvalloissa saarnenjalosoukon on havaittu tappavan terveitäkin saarnia (Silk ja Ryall 2015). Nykykäsityksen mukaan saarnenjalosoukko paikantaa sopivan isäntäpuun saarnen erittämien kemikaalien ja myös puun ulkomuodon perusteella (Silk ym. 2018). Kuoriaisen hyökkäys alkaa saarnen latvaosista ja johtaa puun kuolemiseen useimmiten kolmen vuoden sisällä (Poland ja McCullough 2006; Wessels-Berk ja Scholte 2008).
Saarnilaji ja maantieteellinen sijainti vaikuttavat paljon siihen, miten todennäköisesti saarnenjalosoukko kykenee puita tappamaan (Koch ym. 2015). Perry ym. (2018) raportoivat eteläisestä Michiganista – Yhdysvaltojen invaasion ydinalueelta – yli 99 %:n kuolleisuuden puna- sekä valko- ja mustasaarnella (F. americana L., F. nigra Marshall) vuoteen 2009 mennessä. Toisaalta Robinett ja McCullough (2019) havaitsivat samalla seudulla 28 kohteen inventoinnissa, että valkosaarnen selviytyvyys vaihteli kohteittain huomattavan paljon (0–100 %) ja että pääosa valkosaarnista näytti selviytyneen, vaikka niissä oli merkkejä kuoriaisesta; punasaarnien valtaosa (92 %) sitä vastoin oli kuollut. Pureswaran ja Poland (2009) sekä Tanis ja McCullough (2015) vertailivat eri saarnilajien suosituimmuutta saarnenjalosoukolle Yhdysvalloissa ja havaitsivat, että kuoriainen vaivasi erityisesti valko-, puna- ja mustasaarnea, mutta sinisaarni (Fraxinus quadrangulata Michx.) sekä sikäläiset tuontipuut eurooppalainen lehtosaarni ja mantsuriansaarni kelpasivat huonommin, joskin kuoriaiset söivät myös niitä. Yksi selitys suosituimmuusvaihteluun oli, että eri saarnilajien puolustuskemikaalit erosivat toisistaan huomattavasti. Saarnenjalosoukon on havaittu vaivaavan myös muita puulajeja, kuten partapuuta (Chionanthus virginicus L.) (Cipollini ja Rigsby 2015; Peterson ja Cipollini 2017). Kuoriainen pystyy ainakin laboratorio-oloissa kehittymään saarnen lisäksi myös muilla oliivipuukasvien (Oleceae) lajeilla, kuten oliivipuilla (Olea europaea L.) (Cipollini ym. 2017).
Moskovan seudulta on saarnenjalosoukkohavaintoja puistopuiksi istutetuilta lehtosaarnilta (Orlova-Bienkowskaja ym. 2020). Tällä hetkellä ei tiedetä, miten lehtosaarni sietää saarnenjalosoukkoa kasvaessaan metsäpuuna (Orlova-Bienkowskaja ym. 2020). Jos laji levittäytyy Suomeen, ongelmia ilmennee lähinnä lounaisimmassa Suomessa. Saarnet näyttävät selviytyvän jalosoukon kanssa paremmin, kun ne kasvavat sekapuuna ja harvassa, eivätkä niitä vaivaa muut kasvua ja puolustusta haittaavat tekijät, kuten sienitaudit, kylmyys tai kuivuus (Koch ym. 2015; Greene ja Miliward 2016; Kappler ym. 2018).
4.4 Saarnenjalosoukon torjunta
Suomessa tapaamattomien mutta ihmisen mahdollisesti tänne tuomien karanteenilajien poistaminen kuuluu kasvinterveyslainsäädännön mukaan Ruokavirastolle; lajin asetuttua maahan sen leviämisen seuranta ja haittojen ennakointi metsissä kuuluvat Luonnonvarakeskuksen ja varsinaiset torjuntapäätökset maa- ja metsätalousministeriön sekä Suomen metsäkeskuksen tehtäviin (Laki metsätuhojen torjunnasta (2013/1087)). Kuten johdannon aasianrunkojääräesimerkki osoittaa, vastasaapuneen lajin poistamisen onnistuminen edellyttää nopeaa havaittavuutta.
Valenta ym. (2017) suosittivat vastasaapuneelle vieraslajille mekaanisen, kemiallisen ja biologisen torjunnan yhdistelmää. McCullough ym. (2011) testasivat kuutta puille ruiskutettavaa torjuntakemikaalia Michiganissa 175 saarnipuulla tehdyssä kokeessa. Kaikki ne vähensivät merkittävästi aikuisten lehtiin ja toukkien nilaan kohdistamaa syöntiä tehokkaimman ollessa emamektiinibentsoaatti, joka vähensi aikuisia ja toukkia yli 90 % jopa kaksi vuotta käsittelystä. McKenzie ym. (2010) testasivat neempuun (Azadirachta indica A. Juss.) siemenöljystä saatavaa atsadiraktiinia saarnille ruiskutettuna ja havaitsivat, että kemikaali ei tappanut aikuisia, mutta korkeina annoksina esti toukkien kehittymisen. Yhdeksi torjuntakeinoksi on esitetty myös saarnien kaulaamista pyydyspuiksi ja niiden hävittämistä heti kuoriaisten munittua niihin (McCullough ym. 2016).
Puutavaran mekaaninen ja lämpökäsittely ovat tavallisia menetelmiä tuholaisten leviämisen estämisessä. Osa saarnenjalosoukon toukista ja koteloista selviytyy haketuksesta, jos hakkeen kokoluokka on esimerkiksi 10 cm (McCullough ym. 2007). Saarnihakkeen ja kuormalavojen tehokas lämpökäsittely vaatii verrattain korkean lämpötilan: lähes viidennes toukista ja koteloista selviytyy kaksi tuntia 55 asteessa, mutta jo tunti 60 asteessa tappaa lähes kaikki (McCullough ym. 2007; Sobek ym. 2011). Jalosoukon asuttamien saarnitukkien tehokas käsittely sitä vastoin vaatii 65 asteen uunikuivatuksen (Nzokou ym. 2008).
Saarnimetsikkö voidaan pitää elinkelpoisena myös biologisella torjunnalla. Flower ym. (2014) ja Jennings ym. (2013) havaitsivat, että puiden rungoilla ruokailevat linnut – kuten monet tikat – vierailivat terveitä puita selvästi useammin sellaisilla puilla, joiden latvus oli saarnenjalosoukon vuoksi kuolemassa. Tutkijat havaitsivat puita kuorimalla, että lintujen ruokailu näytti joissakin tapauksissa vähentävän saarnenjalosoukon toukkatiheyttä jopa 85 %.
Saarnenjalosoukon munilla, toukilla tai koteloilla loisivia pistiäislajeja on tutkittu verrattain paljon biologisen torjunnan kannalta. Vieraslajipistiäisen käyttö vieraslaji-isännän torjunnassa saattaa vaikuttaa haitallisesti kotoperäiseen lajistoon, mistä syystä sen erikoistuneisuus täytyy tuntea tarkasti; potentiaalinen ongelma yleensä vältetään, jos löydetään kotoperäinen loispistiäinen. Esimerkiksi Pohjois-Amerikassa Phasgonophora sulcata Westwood käyttää saarnenjalosoukkoa isäntälajinaan vähentäen kuoriutuvien aikuisten määrää jopa kolmanneksella (Roscoe ym. 2016). Muita tässä mielessä lupaavia lajeja ovat Leluthia astigma Ashmead (Kula ym. 2010), Balcha indica Mani & Kaul (McCullough ym. 2011) ja Spathius floridanus Ashmead (Johnson ym. 2014). Venäjällä on ladattu toiveita levinneisyydeltään länsipalearktiseen Spathius polonicus Niezabitowski -lajiin, jota on jo löydetty Moskovan seudulla saarnenjalosoukon jäänteistä ja joka voi tappaa jopa puolet toukista (Orlova-Bienkowskaja ja Belokobylskij 2014; Orlova-Bienkowskaja 2015).
Aasialaisia tuontiloispistiäisiä Spathius agrili Yang, Tetrastichus planipennisi Yang ja Oobius agrili Zhang & Huang on jo toistakymmentä vuotta käytetty Pohjois-Amerikassa saarnenjalosoukon torjunnassa (Ulyshen ym. 2010a, 2010b; Fahrner ym. 2014; Roscoe ym. 2016). Tetrastichus planipennisi ja O. agrili ovat Pohjois-Amerikassa levittäytyneet istutuspaikoilta omin voimin ja näyttävät siis muodostaneen pysyviä kantoja (Duan ym. 2015, 2017; Jennings ym. 2016). Ennen käyttöönottoa loispistiäisten erikoistuneisuutta on tutkittu laboratoriossa altistamalla saarnenjalosoukko ja kotoperäisiä verrokkihyönteislajeja loispistiäiselle. Biologista torjuntaa varten Pohjois-Amerikkaan tuodut S. agrili ja T. planipennisi vaikuttavat erikoistuneen juuri saarnenjalosoukkoon ja saarnen puolustuskemikaalien havaitsemiseen (Bauer ym. 2015). Toisaalta itävenäläinen Oobius primorskyensis Yao & Duan näyttää loisivan useilla Agrilus- mutta ei muilla tutkituilla kovakuoriaislajeilla (Duan ym. 2019). Loispistiäisten torjuntateho vaihtelee paikasta riippuen: esimerkiksi O. agrili on loisinut 1–32 % saarnenjalosoukon toukista (Abell ym. 2014; Duan ym. 2018). Toinen torjunnan onnistumiseen vaikuttava seikka on saarnipuiden koko. Pitkä munanasetin on eduksi paksun kaarnan läpi muniville lajeille, kuten O. agrili (Duan ym. 2019), kun taas T. planipennisi kykenee munimaan ohuemman kaarnan läpi ja siis lähinnä suojaamaan pienempiä puita (Abell ym. 2014). Loispistiäiset myös kilpailevat keskenään: esimerkiksi S. agrili syrjäyttää laboratorio- ja kenttäkokeissa T. planipennisi -lajin (Ulyshen ym. 2010a). Näin ollen biologisen torjunnan menetelmää valittaessa on puulajin ohella huomioitava myös suojattavien puiden laatu, eikä useamman loispistiäisen käyttö välttämättä tuo parempaa torjuntatulosta.
Sienistä Beauveria bassiana (Bals.-Criv.) Vuill. torjuu tehokkaasti saarnenjalosoukkoa (Srei ym. 2020). Luonnostaan tätä sientä tavataan globaalisti maaperässä, mutta se on myös entomopatogeeni, jota on eristetty mm. pohjoisamerikkalaisilta saarnenjalosoukon toukilta ja koteloilta (Castrillo ym. 2010a, 2010b). Sientä on ruiskutettu saarnille saarnenjalosoukon torjuntatarkoituksessa, ja sen on todettu vähentävän kuoriaismääriä yli 40 % ja löytyvän kahden viikon kuluttua viidennekseltä toukista (Liu ja Bauer 2006). Tämän kaupallisen tuotteen (BotaniGard ES) lisäksi saarnenjalosoukolta on Kanadassa eristetty Isaria Pers. ja Purpureocillium Luangsa-Ard, Hywel-Jones, Houbraken & Samson -suvun sieniä, mutta massaesiintymän hillinnässä ne näyttäisivät olevan heikompitehoisia (Johny ym. 2012).
Saarnenjalosoukko, etenkin yhdessä saarnensurman kanssa, voisi uhata tai heikentää pohjoisia vähälukuisia saarniesiintymiä, joilla ei kuitenkaan ole merkitystä teollisuuden raaka-aineena. Laji on kuitenkin merkittävä Etelä-Suomen metsien monimuotoisuudelle: sillä elää verraten rikas seuralaislajisto (Keto-Tokoi ja Siitonen 2021). Saarnenjalosoukon hävittämiseen tähtäävät kasvinterveyslainsäädännön mukaiset isäntäpuuston poistot voisivat olla saarnille yhtä haitallisia kuin itse saarnenjalosoukko. Lajin esiintymistä heikentävät kasvinsuojeluaineruiskutukset esimerkiksi Beauveria bassiana -sienivalmisteilla vaatisivat Tukesista tilanteesta riippuen koetoimintaluvan tai kasvinsuojelun hätätilanteen poikkeusluvan. Luvista huolimatta kookkaiden puiden riittävän huolellinen ruiskuttaminen torjuntavalmisteella olisi hankalaa ja kallista. Yksittäisten arvopuiden suojelemiseksi runkoon tai juurenniskaan injektoitavat insektisidit olisivat helpompia käyttää. Käytännössä valmius ja lupa vapauttaa loispistiäisiä luontoon saarnenjalosoukon torjumiseksi puuttuu.
5 Saarnipistiäinen
5.1 Saarnipistiäisen biologiaa
Saarnipistiäinen on Euroopassa kotoperäinen lehtipistiäisiin (Hymenoptera: Tenthredinidae) kuuluva saarnille erikoistunut laji, jonka kirkkaanvihreät toukat syövät alkukesällä saarnenlehtiä. Aikuinen on väriltään musta. Naaras munii (Kuva 5a) munat vastapuhkeavien nuorten lehtien reunoihin ja alapinnalle sahaamiinsa rakoihin. Munien kehitys kestää tavallisesti alle kaksi viikkoa (Zinchenko ja Kukina 2015 artikkelissa Meshkova ym. 2017) ja toukka-asteita on kaikkiaan viisi (Mrkva 1965; Matošević ym. 2003). Munista kuoriuduttuaan nuoret toukat ovat vaaleita, lähes läpikuultavia, mutta nahanluonnin jälkeen muuttuvat vihreiksi ja vanhetessaan hieman vaalenevat etenkin vatsapuolelta (Matošević ym. 2003). Viimeisen nahanluonnin jälkeen toukan väri on oliivinvihreä, juuri ennen kuin se siirtyy puusta maahan koteloitumaan. Kotelokoppa on tumman kiiltävä ja pergamenttimainen, jonka pinnalla on maaperän partikkeleita kiinnittyneenä (Matošević ym. 2003).

Kuva 5. (a) Saarnipistiäisnaaras valmistautumassa munimaan. (b) Saarnipistiäistoukkien paljaaksi syömä puu. (c) Kuolleita ja eläviä toukkia saarnen tyvellä. (Kuvat: Heikki Nuorteva).
Pistiäisen muodonmuutoksessa toukasta aikuiseksi edeltää koteloituminen, joka tapahtuu vaiheittain nk. jälkitoukan (eonymfi) ja esikotelon (pronymfi) kautta aikuista muistuttavaksi koteloksi. Laji talvehtii jälkitoukkina tai esikoteloina, joita kumpiakin löydettiin Järvenpäästä vuonna 2018 (Viiri ym. 2019). Lämpötilojen noustessa ne kuoriutuvat Suomessa tavallisesti toukokuussa (Viiri ym. 2019; Heikki Nuortevan havainnot), Keski-Euroopassa jo huhtikuun puolella (Mocreac 2020). Lajin elinkierto on yleensä yksivuotinen, mutta osa jälkitoukista voi jättäytyä maahan jopa vuodeksi–pariksi ennen aikuistumistaan. Yleisimmin ensimmäiset aikuiset kuoriutuvat koteloista keväällä samaan aikaan, kun saarnen lehtisilmut ovat avautumassa (Austarå 1991; Heikki Nuortevan havainnot). Parveilu kestää tavallisesti kolmisen viikkoa, ja massaparveilun huippu ajoittuu onnistuessaan vastapuhjenneiden lehtien aikaan. Pienet ensimmäisen asteen toukat tekevät lehtiin aluksi pieniä reikiä, mutta myöhemmät toukka-asteet syövät lehdet kauttaaltaan muutamassa päivässä niin, että vain paksuimmat lehtiruodit jäävät jäljelle (Kuva 5b). Noin kuukauden päästä täysikasvuiset toukat pudottautuvat maahan koteloitumaan. Jos puista loppuu ravinto aikaisemmin tai toukkatiheys kasvaa hyvin suureksi, osa keskenkasvuisista toukista pudottautuu maahan jo aiemmin ja kiipeää ravinnonhaussaan runkoja pitkin naapuripuiden latvuksiin – tai usein jopa saman puun latvukseen. Kaikki toukat eivät selviä koteloitumisvaiheeseen asti, vaan osa kuolee loisten, virusten, ravinnon puutteen tai epäedullisten sääolosuhteiden vuoksi. Kuolleita tai heikkokuntoisia toukkia voi ajoittain esiintyä saarnien tyvellä sadoittain (Verheyde ja Sioen 2019; Heikki Nuortevan havainnot; Kuva 4c).
5.2 Saarnipistiäisen esiintyminen
Saarnipistiäinen on palearktinen laji, jota tavataan kaikkialla Euroopassa sekä idempänä läpi Venäjän Siperian aina Japaniin saakka (Verheyde ja Sioen 2019). Laji aiheuttaa ajoittain merkittäviä tuhoja pääasiassa koriste- ja puistopuille, mutta sitä on tavattu myös laajemmissa saarnimetsiköissä (Benson 1958; Mrkva 1965; Pschorn-Walcher 1982).
Laji on aiemmin ollut melko vähälukuinen, mutta se on runsastunut viimeisten vuosikymmenten aikana. Vielä kymmenkunta vuotta sitten se oli Suomessa luokiteltu uhanalaiseksi (VU), koska sen esiintymisalueiden arvioitiin olevan voimakkaasti pirstoutuneita (Viitasaari ja Paukkunen 2010). Viimeisimmässä uhanalaisuustarkastelussa laji on luokiteltu enää silmällä pidettäväksi (NT) (Paukkunen ym. 2019).
Suomessa lajin havaittiin syövän lehdet yksittäisistä saarnista vuonna 2017 Lohjalla ja Järvenpäässä (Viiri ym. 2018). Tämän jälkeen syötyjä saarnia ja huomiota herättäviä toukkamääriä on havaittu vuosittain kaupunkien ja kulttuuriympäristöjen saarnista. Vuonna 2021 Luonnonvarakeskus vastaanotti 35 ilmoitusta pääosin Uudeltamaalta (Askola, Helsinki, Hyvinkää, Järvenpää, Lohja, Loviisa, Mäntsälä, Porvoo, Raasepori, Sipoo, Vantaa), mutta myös Kymenlaaksosta (Elimäki), Varsinais-Suomesta (Somero) ja Kanta-Hämeestä (Riihimäki). Vuonna 2018 lajin aiheuttamaa syöntiä ei havaittu uusista saarnimetsiköistä (Viiri ym. 2019) eikä saarnimetsiköitä ole tämän jälkeen kartoitettu lajin esiintyvyyden suhteen.
Suomen lisäksi havaintoja saarnipistiäisestä on tehty lukuisissa muissa Euroopan maissa, esimerkiksi Norjassa, Belgiassa, Alankomaissa, Irlannissa, Kroatiassa, Moldovassa ja Ukrainassa (Austarå 1991; Matošević ym. 2003; Jess ym. 2017; Meshkova ym. 2017; Mocreac 2020; Soldi ym. 2022). Raportit lajin runsastumisesta ovat osoittaneet saarnipistiäisen syövän pääasiassa vain yhtä ravintokasvia, ja lajin kehitys on usein samantahtista metsäsaarnen fenologian kanssa (Matošević ym. 2003). Belgiassa saarnipistiäinen esiintyy Etelä- ja Keski-Euroopassa kasvavalla etelänsaarnella (F. angustifolia Vahl) eikä niinkään samoilla paikoilla kasvaneilla lehtosaarnilla, joiden silmujen puhkeaminen tapahtuu siellä huomattavasti etelänsaarnea myöhemmin (Verheyde ja Sioen 2019). Kroatiassa on tehty päinvastaisia havaintoja. Siellä kasvaa sekä etelän- että lehtosaarnea sekä koristepuuna myös punasaarnea muiden Euroopan maiden tapaan; ravinnon ehtyessä ja osan toukista nääntyessä laji ei siirtynyt viereisiin etelänsaarniin (Matošević ym. 2003). Koeolosuhteissa toisen ja kolmannen asteen toukat sen sijaan söivät kaikkien kolmen saarnilajin lehtiä (Matošević ym. 2003). Tuhohavainnot ovat peräisin hyvin usein kulttuuri- ja kaupunkiympäristöistä, missä lehtien syönti helposti havaitaan.
5.3 Saarnipistiäisen torjunta
Koska lehtien syönti ajoittuu alkukesään, saarni ehtii toisinaan kasvattamaan loppukesällä vielä uusia lehtiä kompensoimaan menetettyä fotosynteesikapasiteettiaan. Tämän vuoksi puut eivät aluksi näytä kärsivän merkittävästi. Kuitenkin puut, jotka ovat jo alun perin esimerkiksi saarnensurman heikentämiä tai joutuvat toistuvasti vuosittain toukkien ravinnoksi, voivat merkittävästi heikentyä menettäessään elinvoimaisuuttaan, jolloin riski puun kuolemalle kasvaa.
Saarnipistiäisen populaatiodynamiikasta on melko niukasti tietoa. Lehtiä ja neulasia syövien pistiäisten esiintymät päättyvät usein itsestään muutamassa vuodessa. Esimerkiksi ruskomäntypistiäisillä lajispesifinen monisärmiövirus lisääntyy toukissa vähitellen vuosittain. Saarnipistiäisen luontaiset viholliset ja taudit, jotka voisivat tällä tavoin hillitä kannan tiheyttä, tunnetaan puutteellisesti. Kroatiassa kotelokopista 59 % oli tyhjiä, 19 % loisittuja, 16 % kuolleita tai kuivia eonymfejä, ja vain 8 % oli eläviä eo- tai pronymfejä. Kun tyhjiä ei huomioitu, loisimisasteeksi määritettiin 44 %. (Matošević ym. 2003). Saarnipistiäisen toukilla ja munilla loisivat ahmaspistiäiset (Ichneumonidae) kuuluivat pääosin sukuihin Synoecetes Förster ja Ctenopelma Holmgren (Matošević ym. 2003).
Kroatiassa toimiviksi kasvinsuojeluaineiden tehoaineiksi havaittiin teflubentsuroni ja alfa-sypermetriini (Matošević ym. 2003), jotka eivät ole nykyään hyväksyttyjä EU:ssa (EU Pesticide Database 2022). Myös neem-öljyn havaittiin toimivan, mutta vaikka atsadiraktiini on EU:n tehoainetietokannassa hyväksytty, neem-öljylle ei ole tällä hetkellä hyväksyntää kasvinsuojelukäyttöön Suomessa (Kasvinsuojeluainerekisteri 2022). Käytännössä isojen saarnien latvusten käsittely kasvinsuojeluaineilla on haasteellista. Yksittäisiä arvokkaita saarnia voisi suojata insektisidi-injektioin, kuten Austarå (1991) kokeili Norjassa, mutta Suomessa näitä valmisteita ei ole tällä hetkellä käytössä tai hyväksyttynä edes puistopuiden suojelemiseksi.
Torjuntatoimenpiteinä on kokeiltu runkojen ympäri kiinnitettäviä liimapyydyksiä ja tuhkan levittämistä puiden alle (Viiri ym. 2019; Aarnio ym. 2022), mutta näiden tehosta ei ole tutkimuksia. Paksu tuhkakerros puun tyvellä torjuisi maahan pudonneita toukkia kuivattaen niitä: tuhka on maailman vanhin tunnettu insektisidi (Panagiotakopulu ym. 1995). Liimapannoilla pyydetään toukkia, kun ne ovat pudottautuneet maahan syötyään saarnen ensin lehdettömäksi ja lähtevät kiipeämään runkoja pitkin uuteen tai samaan puuhun. Massaesiintymän aikaan toukkia on niin runsaasti, että liimapaperit täyttyvät nopeasti toukista ja näin menettävät tehonsa, kun uudet toukat kiipeävät takertuneiden toukkien yli. Molemmat keinot ovat työläitä ja lopputulos epävarma, vaikka osa toukista saataisiinkin hävitettyä. Kumpikaan keinoista ei vähennä latvuksessa syömässä olevien toukkien määrää.
Monet metsän tavallisimmat varpuslinnut – esimerkiksi tiaiset, siepot ja uunilinnut – syövät monien lehtiä syövien hyönteisten toukkia (esim. Mäntylä ym. 2010). Saarnipistiäisen massaesiintymän aikaan toukkia voi olla niin valtavasti, että paikallinen lintupopulaatio ei välttämättä saa ainakaan valtaosaa niistä hyödynnettyä. Linnut kuitenkin voivat toukkia syömällä merkittävästikin säädellä hyönteisten massaesiintymien voimakkuutta ja kestoa, kuten on osoitettu mm. kuusikääriäisellä (Choristoneura fumiferana Clem.) (Venier ja Holmes 2010).
6 Johtopäätökset
Suomessa ei juuri ole vierasperäisiä metsätuholaisia (Santini 2013). Tämä johtunee osin monille tuhonaiheuttajille liian kylmistä talvista mutta myös kansainvälisen kasvi- ja kasvimateriaalikaupan vähäisyydestä. Saarnensurman saapuminen Suomeen kuitenkin osoittaa, että myös Suomen metsiin kohdistuu riski kansainvälisen kasvi- ja kasvimateriaalikaupan mukana siirtyvien eliöiden vallatessa uusia alueita. Toisaalta saarnipistiäisen yleistyminen kertoo siitä, että ilmastonmuutos muuttaa Suomen olosuhteita yhä useammille luontaisesti levittäytyville lajeille suotuisiksi – joukossa on myös puustotuholaisia.
Metsänomistajan kannalta erityisten torjuntakeinojen käyttäminen tässä artikkelissa esiteltyjä tuhonaiheuttajia vastaan on nykyisin tarpeetonta, koska saarnensurman torjuminen metsissä on käytännössä mahdotonta, saarnipistiäistä vastaan on käytettävissä vain työläitä ja epävarmoja torjuntakeinoja ja saarnenjalosoukon osalta on tässä vaiheessa oleellista vain estää sen pääsy ja asettautuminen Suomeen. Puistomaisissa olosuhteissa syksyisten saarnenlehtien haravointi on kuitenkin järkevää, koska se vähentää uutta saarnensurmatartuntaa. Yleisellä tasolla olisi hyödyllistä edistää perinnöllisesti kestävän taimimateriaalin tuottamista saarnensurmaa vastaan ja seurata itärajan läheisyydessä saarnenjalosoukon ilmaantumista maahamme sekä varautua toimenpiteisiin sen poistamiseksi tarvittaessa.
Kaiken kaikkiaan yksi eniten Euroopan unionin alueella vieraslajeista kärsineistä lajeista on ollut saarnensurman vaivaama lehtosaarni, jonka tilanteen voi olettaa vaikeutuvan entisestään, mikäli saarnenjalosoukko leviää alueelle. Toisaalta saattaa olla, että saarnenjalosoukon leviäminen vaikeutuu niillä alueilla, joilta saarnensurma on jo ehtinyt tappaa useimmat saarnet tai joilla puulaji on luonnostaan harvinainen tai paikoittainen, kuten Suomessa. Joka tapauksessa olisi erityisen tärkeää, että kansainvälisen kaupan mukana kulkeutuvien vierasperäisten tuhonaiheuttajien leviämisen estämiseksi kehitettäisiin myös jatkossa uusia keinoja ja menetelmiä viranomaisten käytettäväksi sekä kiinnitettäisiin erityistä huomiota kasvi- ja kasvimateriaalikaupan tuotantoketjujen puhtauteen asettamalla kannustimia alan toimijoiden motivoimiseksi (Hantula ym. 2014).
Tutkimusdatan avoimuus
Kirjoitus ei sisällä alkuperäisdatan analyysejä vaan perustuu julkaistuun tietoon.
Kirjoittajien työnjako
Kaikki tekijät osallistuivat käsikirjoituksen kirjoittamiseen. JH kirjoitti pääosan saarnensurmaa, MK saarnenjalosoukkoa sekä HN ja TY saarnipistiäistä koskevasta osuudesta. Lisäksi kaikki tekijät kommentoivat kokonaisuutta sekä osallistuivat tiivistelmän, johdannon ja johtopäätösten kirjoittamiseen. JH hankki saarnensurma-, MK saarnenjalosoukkoa ja HN saarnipistiäistä esittävät kuvat ja karttakuvan tehtiin kaikkien neljän kirjoittajan yhteistyönä. Käsikirjoituksen viimeisteli JH.
Kiitokset
Kiitämme Michael Mülleriä ja Marina Orlova-Bienkowskajaa valokuvista sekä Luonnonvarakeskuksen metsätuhotietopalvelua työn rahoituksesta sekä Jan Stenlidiä, Erik Kjæria ja Marina Orlova-Bienkowskajaa henkilökohtaisista tiedonannoista.
Rahoitus
Kirjoitustyö tehtiin osana Luonnonvarakeskuksen metsätuhotietopalvelua. Valmistelevaa työtä tehtiin myös osana “Vieraslajit – Osaamisen ja aineistojen vaihdon yhteistyöverkosto – DIAS” (KA 5046) -hanketta, jota rahoittivat Euroopan unioni, Suomi ja Venäjä Karelia CBC -ohjelman kautta.
Lähteet
Aarnio L, Nuorteva H, Ylioja T (2022) Kansalaisten tekemien metsätuhoilmoitusten satoa vuodelta 2021. Julkaisussa: Melin M, Terhonen E (toim) Metsätuhot vuonna 2021. Luonnonvara- ja biotalouden tutkimus 38/2022. Luonnonvarakeskus, Helsinki, s. 7–14. http://urn.fi/URN:ISBN:978-952-380-423-4.
Abell KJ, Bauer LS, Duan JJ, Van Driesche R (2014) Long-term monitoring of the introduced emerald ash borer (Coleoptera: Buprestidae) egg parasitoid, Oobius agrili (Hymenoptera: Encyrtidae), in Michigan, USA and evaluation of a newly developed monitoring technique. Biol Contr 79: 36–42. https://doi.org/10.1016/j.biocontrol.2014.08.002.
Anagnostakis SL (1982) Biological control of chestnut blight. Science 215: 466–471. https://doi.org/10.1126/science.215.4532.466.
Austrarå Ø (1991) Severe outbreaks of the Ash sawfly Tomostethus nigritus F. (Hymenoptera: Tenthredinidae) on ornamental trees in Oslo. Anzeiger für Schadlingskunde, Pflanzenschutz und Umweltschutz 64: 70–72. https://doi.org/10.1007/BF01906165.
Baral HO, Queloz V, Hosoya T (2014) Hymenoscyphus fraxineus, the correct scientific name for the fungus causing ash dieback in Europe. IMA fungus 5: 79–80. https://doi.org/10.5598/imafungus.2014.05.01.09.
Bauer LS, Duan JJ, Gould, JR, Van Driesche R (2015) Progress in the classical biological control of Agrilus planipennis Fairmaire (Coleoptera: Buprestidae) in North America. Can Entomol 147: 641–641. https://doi.org/10.4039/tce.2015.54.
Becker R, Ulrich K, Behrendt U, Kube M, Ulrich A (2020) Analyzing ash leaf-colonizing fungal communities for their biological control of Hymenoscyphus fraxineus. Front Microbiol 11, article id 590944. https://doi.org/10.3389/fmicb.2020.590944.
Bengtsson SBK, Vasaitis R, Kirisits T, Solheim H, Stenlid J (2012) Population structure of Hymenoscyphus pseudoalbidus and its genetic relationship to Hymenoscyphus albidus. Fungal Ecol 5: 147–153. https://doi.org/10.1016/j.funeco.2011.10.004.
Benson RB (1958) . Hymenoptera – Symphyta. Handbooks for the identification of British insects 6: 51–137. Royal Entomological Society of London.
Brasier CM (1991) Ophiostoma novo-ulmi sp. nov., causative agent of the current Dutch elm disease pandemics. Mycopathologia 115: 151–161. https://doi.org/10.1007/BF00462219.
Bray AM, Bauer LS, Poland TM, Haack RA, Cognato AI, Smith JJ (2011) Genetic analysis of emerald ash borer (Agrilus planipennis Fairmaire) populations in Asia and North America. Biol Invasions 13: 2869–2887. https://doi.org/10.1007/s10530-011-9970-5.
Brown-Rytlewski DE, Wilson MA (2005) Tracking the emergence of emerald ash borer adults. Julkaisussa: Mastro V, Reardon R (toim) Emerald ash borer research and technology development meeting. FHTET-2004-15, USDA Forest Service, Morgantown, West Virginia, s. 13–14.
Castrillo LA, Bauer LS, Liu HP, Griggs MH, Vandenberg JD (2010a) Characterization of Beauveria bassiana (Ascomycota: Hypocreales) isolates associated with Agrilus planipennis (Coleoptera: Buprestidae) populations in Michigan. Biol Contr 54: 135–140. https://doi.org/10.1016/j.biocontrol.2010.04.005.
Castrillo LA, Griggs MH, Liu HP, Bauer LS, Vandenberg JD (2010b) Assessing deposition and persistence of Beauveria bassiana GHA (Ascomycota: Hypocreales) applied for control of the emerald ash borer, Agrilus planipennis (Coleoptera: Buprestidae), in a commercial tree nursery. Biol Control 54: 61–67. https://doi.org/10.1016/j.biocontrol.2010.03.005.
Cipollini D, Rigsby CM (2015) Incidence of Infestation and Larval Success of Emerald Ash Borer (Agrilus planipennis) on White Fringetree (Chionanthus virginicus), Chinese Fringetree (Chionanthus retusus), and Devilwood (Osmanthus americanus). Environ Entomol 44: 1375–1383. https://doi.org/10.1093/ee/nvv112.
Cipollini D, Rigsby CM, Peterson DL (2017) Feeding and development of emerald ash borer (Coleoptera: Buprestidae) on cultivated olive, Olea europaea. J Econ Entomol 110: 1935–1937. https://doi.org/10.1093/jee/tox139.
Cleary M, Nguyen D, Marčiulynienė D, Berlin A, Vasaitis R, Stenlid J (2016) Friend or foe? Biological and ecological traits of the European ash dieback pathogen Hymenoscyphus fraxineus in its native environment. Sci Rep 6: 1–11. https://doi.org/10.1038/srep21895.
Crosthwaite JC, Sobek S, Lyons DB, Bernards MA, Sinclair BJ (2011) The overwintering physiology of the emerald ash borer, Agrilus planipennis Fairmaire (Coleoptera: Buprestidae). J Insect Physiol 57: 166–173. https://doi.org/10.1016/j.jinsphys.2010.11.003.
Donovan GH, Butry DT, Michael YL, Prestemon JP, Liebhold AM, Gatziolis D, Mao MY (2013) The relationship between trees and human health – evidence from the emerald ash borer. Am J Prev Med 44: 139–145. https://doi.org/10.1016/j.amepre.2012.09.066.
Drenkhan R, Solheim H, Bogacheva A, Riit T, Adamson K, Drenkhan T, Maaten T, Hietala AM (2017) Hymenoscyphus fraxineus is a leaf pathogen of local Fraxinus species in the Russian Far East. Plant Pathol 66: 490–500. https://doi.org/10.1111/ppa.12588.
Drogvalenko AN, Orlova-Bienkowskaja MJ, Bienkowski AO (2019) Record of the emerald ash borer (Agrilus planipennis) in Ukraine is confirmed. Insects 10, article id 338. https://doi.org/10.3390/insects10100338.
Duan J, Ladd T, Doucet D, Cusson M, van Frankenhuyzen K, Mittapalli O, Krell PJ, Quan GX (2015) Transcriptome analysis of the emerald ash borer (EAB), Agrilus planipennis: de novo assembly, functional annotation and comparative analysis. PloOS One 10, article id e0134824. https://doi.org/10.1371/journal.pone.0134824.
Duan J, Quan GX, Mittapalli O, Cusson M, Krell PJ, Doucet D (2017) The complete mitogenome of the Emerald Ash Borer (EAB), Agrilus planipennis (Insecta: Coleoptera: Buprestidae). Mitochondrial DNA B: Resour 2: 134–135. https://doi.org/10.1080/23802359.2017.1292476.
Duan JJ, Bauer LS, Van Driesche RG (2018) Progress and challenges of protecting North American ash trees from the emerald ash borer using biological control. Forests 9: 1–17. https://doi.org/10.3390/f9030142.
Duan JJ, Schmude JM, Larson KM, Fuester RW, Gould JR, Ulyshen MD (2019) Field parasitism and host specificity of Oobius primorskyensis (Hymenoptera: Encyrtidae), an egg parasitoid of the emerald ash borer (Coleoptera: Buprestidae) in the Russian Far East. Biol Contr 130: 44–50. https://doi.org/10.1016/j.biocontrol.2018.12.005.
EPPO 2013. PM 9/14 (1) Agrilus planipennis: procedures for official control. EPPO Bull. 43: 499–509. https://doi.org/10.1111/epp.12063.
EU pesticides database (2022) https://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/active-substances/. Viitattu 1.3.2022
Evans HF, Williams D, Hoch G, Loomans A, Marzano M (2020) Developing a European toolbox to manage potential invasion by emerald ash borer (Agrilus planipennis) and bronze birch borer (Agrilus anxius), important pests of ash and birch. Forestry 93: 187–196. https://doi.org/10.1093/forestry/cpz074.
Fahrner SJ, Lelito JP, Blaedow K, Heimpel GE, Aukema BH (2014) Factors affecting the flight capacity of Tetrastichus planipennisi (Hymenoptera: Eulophidae), a classical biological control agent of Agrilus planipennis (Coleoptera: Buprestidae). Environ Entomol 43: 1603–1612. https://doi.org/10.1603/EN14139.
Fahrner SJ, Lelito JP, Aukema BH (2015) The influence of temperature on the flight capacity of emerald ash borer Agrilus planipennis and its parasitoid, Tetrastichus planipennisi: implications to biological control. Biocontrol 60: 437–449. https://doi.org/10.1007/s10526-015-9657-4.
Flower CE, Long LC, Knight KS, Rebbeck J, Brown JS, Gonzalez-Meler MA, Whelan CJ (2014) Native bark-foraging birds preferentially forage in infected ash (Fraxinus spp.) and prove effective predators of the invasive emerald ash borer (Agrilus planipennis Fairmaire). For Ecol Manag 313: 300–306. https://doi.org/10.1016/j.foreco.2013.11.030.
Fones HN, Mardon C, Gurr SJ (2016) A role for the asexual spores in infection of Fraxinus excelsior by the ash-dieback fungus Hymenoscyphus fraxineus. Sci Rep 6, article id 34638. https://doi.org/10.1038/srep34638.
Greene CS, Miliward AA (2016) The legacy of past tree planting decisions for a city confronting emerald ash borer (Agrilus planipennis) invasion. Front Ecol Evol 4, article id 27. https://doi.org/10.3389/fevo.2016.00027.
Gross A, Hosoya T, Queloz V (2014) Population structure of the invasive forest pathogen Hymenoscyphus pseudoalbidus Mol Ecol 23: 2943–2960. https://doi.org/10.1111/mec.12792.
Han JG, Shrestha B, Hosoya T, Lee KH, Sung GH, Shin HD (2014) First report of the ash dieback pathogen Hymenoscyphus fraxineus in Korea. Mycobiology 42: 391–396. https://doi.org/10.5941/MYCO.2014.42.4.391.
Hantula J, Müller MM, Uusivuori J (2014) International plant trade associated risks: laissez-faire or novel solutions. Environ Sci Policy 37: 158–160. https://doi.org/10.1016/j.envsci.2013.09.011.
Herms DA (2004) Using degree-days and plant phenology to predict pest activity. Julkaisussa: Krischik V, Davidson J (toim) Integrated pest management of midwest landscapes. Minnesota Agricultural Experiment Station Publication SB-07645, St. Paul, Minnesota, s. 49–59
Herms DA, McCullough DG (2014). Emerald ash borer invasion of North America: history, biology, ecology, impacts, and management. Annu Rev Entomol 59: 13–30. https://doi.org/10.1146/annurev-ento-011613-162051.
Hessenauer P, Fijarczyk A, Martin H, Prunier J, Charron G, Chapuis J, Bernier L, Tanguay P, Hamelin RC, Landry CR (2020). Hybridization and introgression drive genome evolution of Dutch elm disease pathogens. Nat Ecol Evol 4: 626–638. https://doi.org/10.1038/s41559-020-1133-6.
Jennings DE, Gould JR, Vandenberg JD, Duan JJ, Shrewsbury PM (2013) Quantifying the impact of woodpecker predation on population dynamics of the emerald ash borer (Agrilus planipennis). PloS One 8, article id e83491. https://doi.org/10.1371/journal.pone.0083491.
Jennings DE, Duan JJ, Shrewsbury PM (2015) Biotic mortality factors affecting emerald ash borer (Agrilus planipennis) are highly dependent on life stage and host tree crown condition. Bull Entomol Res 105: 598–606. https://doi.org/10.1017/S0007485315000498.
Jennings DE, Duan JJ, Bauer LS, Schmude JM, Wetherington MT, Shrewsbury PM (2016) Temporal dynamics of woodpecker predation on emerald ash borer (Agrilus planipennis) in the northeastern USA. Agric For Entomol 18: 174–181. https://doi.org/10.1111/afe.12142.
Jennings DE, Duan JJ, Bean D, Rice KA, Williams GL, Bell SK, Shurtleff AS, Shrewsbury PM (2017) Effects of the emerald ash borer invasion on the community composition of arthropods associated with ash tree boles in Maryland, U.S.A. Agric For Entomol 19: 122–129. https://doi.org/10.1111/afe.12186.
Jess S, Murchie A Allen D, Crory A (2017) First observation of Tomostethus nigritus (Fabricius) (Hymenoptera: Tenthredinidae) on urban ash trees in Ireland. Ir Nat J 35: 134–136. https://www.jstor.org/stable/44577844.
Johnson TD, Lelito JP, Raffa KF (2014) Responses of two parasitoids, the exotic Spathius agrili Yang and the native Spathius floridanus Ashmead, to volatile cues associated with the emerald ash borer, Agrilus planipennis Fairmaire. Biol Contr 79: 110–117. https://doi.org/10.1016/j.biocontrol.2014.05.004.
Johny S, Kyei-Poku G, Gauthier D, van Frankenhuyzen K (2012) Isolation and characterisation of Isaria farinosa and Purpureocillium lilacinum associated with emerald ash borer, Agrilus planipennis in Canada. Biocontrol Sci Technol 22: 723–732. https://doi.org/10.1080/09583157.2012.677808.
Kappler RH, Knight KS, Koch J, Root KV (2018) Neighboring tree effects and soil nutrient associations with surviving green ash (Fraxinus pennsylvanica) in an emerald ash borer (Agrilus planipennis) infested floodplain forest. Forests 9, article id 183. https://doi.org/10.3390/f9040183.
Kasvinsuojeluainerekisteri (2022) https://www.kemidigi.fi/kasvinsuojeluainerekisteri/haku. Viitattu 1.3.2022.
Keto-Tokoi P, Siitonen J (2021) Puiden asukkaat. Suomen puiden seuralaislajit. Gaudeamus. ISBN 9789523451339.
Kirisits T, Schwanda K. (2015) First definite report of natural infection of Fraxinus ornus by Hymenoscyphus fraxineus. For Pathol 45: 430–432. https://doi.org/10.1111/efp.12211.
Kjaer ED, McKinney LV, Nielsen LR, Hansen LN, Hansen JK (2012) Adaptive potential of ash (Fraxinus excelsior) populations against the novel emerging pathogen Hymenoscyphus pseudoalbidus. Evol Appl 5: 219–228. https://doi.org/10.1111/j.1752-4571.2011.00222.x.
Koch JL, Carey DW, Mason ME, Poland TM, Knight KS (2015) Intraspecific variation in Fraxinus pennsylvanica responses to emerald ash borer (Agrilus planipennis). New For 46: 995–1011. https://doi.org/10.1007/s11056-015-9494-4.
Kowalski T (2006) Chalara fraxinea sp. nov. associated with dieback of ash (Fraxinus excelsior) in Poland. For Pathol 36: 264–270. https://doi.org/10.1111/j.1439-0329.2006.00453.x.
Kowalski T, Holdenrieder O (2009) Pathogenicity of Chalara fraxinea. For Pathol 39: 1–7. https://doi.org/10.1111/j.1439-0329.2008.00565.x.
Kula RR, Knight KS, Rebbeck J, Bauer LS, Cappaert DL, Gandhi KJK (2010) Leluthia astigma (ashmead) (Hymenoptera: Braconidae: Doryctinae) as a parasitoid of Agrilus planipennis Fairmaire (Coleoptera: Buprestidae: Agrilinae), with an assessment of host associations for nearctic species of Leluthia cameron. Proc Entomol Soc Wash 112: 246–257. https://doi.org/10.4289/0013-8797-112.2.246.
Lilja A, Rytkönen A, Hantula J, Müller M, Parikka P, Kurkela T (2011) Introduced pathogens found on ornamentals, strawberry and trees in Finland over the past 20 years. Agric Food Sci 20: 74–85. https://doi.org/10.2137/145960611795163051.
Liu HP, Bauer LS (2006) Susceptibility of Agrilus planipennis (Coleoptera : Buprestidae) to Beauveria bassiana and Metarhizium anisopliae. J Econ Entomol 99: 1096–1103. https://doi.org/10.1093/jee/99.4.1096.
Liu HP, Bauer LS, Miller DL, Zhao TH, Gao RT, Song LW, Luan QS, Jin RZ, Gao CQ (2007) Seasonal abundance of Agrilus planipennis (Coleoptera : Buprestidae) and its natural enemies Oobius agrili (Hymenoptera : Encyrtidae) and Tetrastichus planipennisi (Hymenoptera : Eulophidae) in China. Biol Contr 42: 61–71. https://doi.org/10.1016/j.biocontrol.2007.03.011.
Lygis V, Vasiliauskas R, Larsson K-H, Stenlid J (2005) Wood-inhabiting fungi in stems of Fraxinus excelsior in declining ash stands of northern Lithuania, with particular reference to Armillaria cepistipes. Scand J For Res 20: 337–346. https://doi.org/10.1080/02827580510036238.
Maa- ja metsätalousministeriö (2012) Kansallinen vieraslajistrategia. Maa- ja metsätalousministeriö, Helsinki. https://vieras-cms.laji.fi/wp-content/uploads/2020/08/Vieraslajistrategia_web_pieni.pdf. Viitattu 31.8.2022.
Maa- ja metsätalousministeriö (2021) Vieraslajit. https://mmm.fi/vieraslajit. Viitattu 22.10.2021.
Madsen CL, Kosawang C, Thomsen IM, Hansen LN, Nielsen LR, Kjaer ED (2021) Combined progress in symptoms caused by Hymenoscyphus fraxineus and Armillaria species, and corresponding mortality in young and old ash trees. For Ecol Manag 491, article id 119177. https://doi.org/10.1016/j.foreco.2021.119177.
Matisone I, Matisons R, Laiviņš M, Gaitnieks T (2018) Statistics of ash dieback in Latvia. Silva Fenn 52, article id 9901. https://doi.org/10.14214/sf.9901.
Matošević D, Hrašovec B, Pernek M (2003) Spread and character of Tomostethus nigritus F. outbreaks in Croatia during the last decade. Julkaisussa: McManus ML, Liebhold AM (toim) Proceedings – Ecology, Survey and Management of Forest Insects, Krakow, Poland, syyskuu 1–5, 2003, s. 39–43.
McCullouch DG, Poland TM, Cappaert D, Clark, EL, Fraser I, Mastro V, Smith S, Pell C (2007) Effects of chipping, grinding, and heat on survival of emerald ash borer, Agrilus planipennis (Coleoptera: Buprestidae), in chips. J Econ Entomol 100: 1304–1315. https://doi.org/10.1093/jee/100.4.1304.
McCullough DG, Poland TM, Anulewicz AC, Lewis P, Cappaert D (2011) Evaluation of Agrilus planipennis (Coleoptera: Buprestidae) control provided by Emamectin Benzoate and two neonicotinoid insecticides, one and two seasons after treatment. J Econ Entomol 104: 1599–1612. https://doi.org/10.1603/EC11101.
McCullough DG, Poland TM, Lewis PA (2016) Lethal trap trees: a potential option for emerald ash borer (Agrilus planipennis Fairmaire) management. Pest Manag Sci 72: 1023–1030. https://doi.org/10.1002/ps.4083.
McDonald BA, Linde C (1993) Pathogen population genetics, evolutionary potential, and durable resistance. Annu Rev Phytopathol 40: 349–379. https://doi.org/10.1146/annurev.phyto.40.120501.101443.
McKenzie N. Helson B, Thompson D, Otis G, Mcfarlane J, Buscarini T, Meating J (2010) Azadirachtin: an effective systemic insecticide for control of Agrilus planipennis (Coleoptera: Buprestidae). J Econ Entomol 103: 708–717. https://doi.org/10.1603/EC09305.
McKinney LV, Thomsen IM, Kjær ED, Bengtsson SBK, Nielsen LR (2012). Rapid invasion by an aggressive pathogenic fungus (Hymenoscyphus pseudoalbidus) replaces a native decomposer (Hymenoscyphus albidus): a case of local cryptic extinction? Fungal Ecol 5: 663–669. https://doi.org/10.1016/j.funeco.2012.05.004.
Mercader RJ, Siegert NW, Liebhold AM, McCullough DG (2009) Dispersal of the emerald ash borer, Agrilus planipennis, in newly-colonized sites. Agric For Entomol 11: 421–424. https://doi.org/10.1111/j.1461-9563.2009.00451.x.
Mercader RJ, McCullough DG, Storer AJ, Bedford JM, Heyd R, Siegert NW, Katovich S, Poland TM (2016) Estimating local spread of recently established emerald ash borer, Agrilus planipennis, infestations and the potential to influence it with a systemic insecticide and girdled ash trees. For Ecol Manag 366: 87–97. https://doi.org/10.1016/j.foreco.2016.02.005.
Meshkova V, Kukina O, Zinchenko O, Davydenko K (2017) Three-year dynamics of common ash defoliation and crown condition in the focus of black sawfly Tomostethus nigritus F. (Hymenoptera: Tenthredinidae). Balt For 23: 303–308.
Mocreac SN (2020) Tomostethus nigritus F. (Hymenoptera, Tenthredinidae) – a new pest species of ash tree in the Republic of Moldova. Oltenia-studii si comunicari stiintele naturii 36: 90–95.
Morin RS, Liebhold AM, Pugh SA, Crocker SJ (2017) Regional assessment of emerald ash borer, Agrilus planipennis, impacts in forests of the Eastern United States. Biol Invasions 19: 703–711. https://doi.org/10.1007/s10530-016-1296-x.
Mrkva R (1965) Beitrag zur Kenntnis der Morphologie, Bionomie und der Parasiten der schwarzen Eschenblattwespe (Tomostethus nigritus [Fabr.]). Práce výzkumných ústavu lesnických CSSR 30: 33–64.
Muirhead JR, Leung B, van Overdijk C, Kelly DW, Nandakumar K, Marchant KR, MacIsaac HJ (2006) Modelling local and long-distance dispersal of invasive emerald ash borer Agrilus planipennis (Coleoptera) in North America. Divers Distrib 12: 71–79. https://doi.org/10.1111/j.1366-9516.2006.00218.x.
Mäntylä E, Klemola T, Laaksonen T (2010) Birds help plants: a meta-analysis of top-down trophic cascades caused by avian predators. Oecologia 165: 143–151. https://doi.org/10.1007/s00442-010-1774-2.
Nzokou P, Tourtellot S, Kamdem DP (2008) Kiln and microwave heat treatment of logs infested by the emerald ash borer (Agrilus planipennis Fairmaire) (Coleoptera: Buprestidae). For Prod J 58: 68–72.
Orlova-Bienkowskaja MJ (2015) Cascading ecological effects caused by the establishment of the emerald ash borer Agrilus planipennis (Coleoptera: Buprestidae) in European Russia. Eur J Entomol 112: 778–789. https://doi.org/10.14411/eje.2015.102.
Orlova-Bienkowskaja MJ, Belokobylskij SA (2014) Discovery of the first European parasitoid of the emerald ash borer Agrilus planipennis (Coleoptera: Buprestidae). Eur J Entomol 111: 594–596. https://doi.org/10.14411/eje.2014.061.
Orlova-Bienkowskaja MJ, Bienkowski AO (2020) Minimum winter temperature as a limiting factor of the potential spread of Agrilus planipennis, an alien pest of ash trees, in Europe. Insects 11, article id 258. https://doi.org/10.3390/insects11040258.
Orlova-Bienkowskaja MJ, Volkovitsh MG (2018) Are native ranges of the most destructive invasive pests well known? A case study of the native range of the emerald ash borer, Agrilus planipennis (Coleoptera: Buprestidae). Biol Invasions 20: 1275–1286. https://doi.org/10.1007/s10530-017-1626-7.
Orlova-Bienkowskaja MJ, Drogvalenko AN, Zabaluev IA, Sazhnev AS, Peregudova EY, Mazurov SG, Komarov EV, Struchaev VV, Martynov VV, Nikulina TV, Bienkowski AO (2020) Current range of Agrilus planipennis Fairmaire, an alien pest of ash trees, in European Russia and Ukraine. Ann For Sci 77, article id 29. https://doi.org/10.1007/s13595-020-0930-z.
Panagiotakopulu E, Buckland PC, May PM, Sarpaki AA, Doumas C (1995) Natural insecticides and insect repellents in Antiquity: a review of the evidence. J Archaeol Sci 22: 705–710. https://doi.org/10.1016/S0305-4403(95)80156-1.
Paukkunen J, Viitasaari M, Mutanen M, Raekunnas M (2019) Sahapistiäiset – Sawflies Symphyta. Julkaisussa: Hyvärinen E, Juslén A, Kemppainen E, Uddström A, Liukko U-M (toim) Suomen lajien uhanalaisuus – Punainen kirja 2019. Ympäristöministeriö & Suomen ympäristökeskus, Helsinki, s. 431–438. http://hdl.handle.net/10138/299501.
Pautasso M, Aas G, Queloz V, Holdenrieder O (2013) European ash (Fraxinus excelsior) dieback – a conservation biology challenge. Biol Conserv 158: 37–49. https://doi.org/10.1016/j.biocon.2012.08.026.
Peregudova EY (2019) The focus of the emerald ash borer Agrilus planipennis Fairmaire (Coleoptera: Buprestidae) in Tver, on the northwestern border of the invasive range. Russ J Biol Invasions 10: 258–262. http://doi.org/10.1134/S2075111719030093.
Perry KI, Herms DA, Klooster WS, Smith A, Hartzler DM, Coyle DR, Gandhi KJK (2018) Downed coarse woody debris dynamics in ash (Fraxinus spp.) stands invaded by emerald ash borer (Agrilus planipennis Fairmaire). Forests 9, article id 191. https://doi.org/10.3390/f9040191.
Peterson DL, Cipollini D (2017) Distribution, predictors, and impacts of emerald ash borer (Agrilus planipennis) (Coleoptera: Buprestidae) infestation of white fringetree (Chionanthus virginicus). Environ Entomol 46: 50–57. https://doi.org/10.1093/ee/nvw148.
Poland TM, McCullough DG (2006) Emerald ash borer: invasion of the urban forest and the threat to North America’s ash resource. J Forest 104: 118–124. https://doi.org/10.1093/jof/104.3.118.
Przybyl K (2002) Fungi associated with necrotic apical parts of Fraxinus excelsior shoots. For Pathol 32: 387–394. https://doi.org/10.1046/j.1439-0329.2002.00301.x.
Pschorn-Walcher H (1982) Tomostethus nigritus F., Schwarze Eschenblattwespe. Julkaisussa: Schwenge W (toim) Die Forstschädlinge Europas. 4. Band. Hautflügler und Zweiflügler, Verlag Paul Parey, s. 131–132. ISBN 3490114167.
Pureswaran DS, Poland TM (2009) Host selection and feeding preference of Agrilus planipennis (Coleoptera: Buprestidae) on ash (Fraxinus spp.). Environ Entomol 38: 757–765. https://doi.org/10.1603/022.038.0328.
Queloz V, Grünig CR, Berndt, R, Kowalski T, Sieber TN, Holdenrieder O (2011) Cryptic speciation in Hymenoscyphus albidus. For Pathol 41: 133–142. https://doi.org/10.1111/j.1439-0329.2010.00645.x.
Rebek EJ, Herms DA, Smitley DR (2008) Interspecific variation in resistance to emerald ash borer (Coleoptera: Buprestidae) among North American and Asian ash (Fraxinus spp.). Environ Entomol 37: 242–246. https://doi.org/10.1603/0046-225X(2008)37[242:IVIRTE]2.0.CO;2.
Robinett MA, McCullough DG (2019) White ash (Fraxinus americana) survival in the core of the emerald ash borer (Agrilus planipennis) invasion. Can J For Res 49: 510–520. https://doi.org/10.1139/cjfr-2018-0320.
Roques A, Rabitsch W, Rasplus JY, Lopez-Vamonde C, Nentwig W, Kenis M (2009) Alien terrestrial invertebrates of Europe. Julkaisussa: Drake JA (toim) Handbook of alien species in Europe, DAISIE. Invading nature, series in invasion ecology vol. 3. Springer, Berlin, Germany, s. 63–79. ISBN 978-94-017-7693-6.
Roscoe LE, Lyons DB, Smith SM (2016) Observations on the life-history traits of the North American parasitoid Phasgonophora sulcata Westwood (Hymenoptera: Chalcididae) attacking Agrilus planipennis (Coleoptera: Buprestidae) in Ontario, Canada. Can Entomol 148: 294–306. https://doi.org/10.4039/tce.2015.72.
Ruokavirasto (2021) Vantaan aasianrunkojääräesiintymä 2015–2020. https://www.ruokavirasto.fi/viljelijat/kasvintuotanto/kasvinterveys/kasvintuhoojat/karanteenituhoojat/aasianrunkojaara/vantaan-esiintyma/. Viitattu 22.10.2021.
Rytkönen A, Lilja A, Drenkhan R, Gaitnieks T, Hantula J (2011) First record of Chalara fraxinea in Finland and genetic variation among samples from Åland, mainland Finland, Estonia and Latvia For Pathol 41: 169–174. https://doi.org/10.1111/j.1439-0329.2010.00647.x.
Salingre G, Väkevä J, Varama M, Kankaanhuhta V (2003) Ruskomäntypistiäinen (Neodiprion sertifer). Metsäntutkimuslaitos. http://www.metla.fi/metinfo/metsienterveys/lajit_kansi/nesert-n.htm. Viitattu 31.8.2022.
Santini A, Ghelardini L, De Pace C, Desprez-Loustau ML, Capretti P, Chandelier A, Cech T, Chira D, Diamandis S, Gaitnieks T, Hantula J, Holdenrieder O, Jankovsky L, Jung T, Jurc D, Kirisits T, Kunca A, Lygis V, Malecka M, Marcais B, Schmitz S, Schumacher J, Solheim H, Solla A, Szabò I, Tsopelas P, Vannini A, Vettraino AM, Woodward S, Webber J, Stenlid J (2013) Biogeographic patterns and determinants of invasion by alien forest pathogenic fungi in Europe. New Phytol 197: 238–250. https://doi.org/10.1111/j.1469-8137.2012.04364.x.
Schoebel CN, Botella L, Lygis V, Rigling D (2017), Population genetic analysis of a parasitic mycovirus to infer the invasion history of its fungal host. Mol Ecol 26: 2482–2497. https://doi.org/10.1111/mec.14048.
Selikhovkin AV, Popovichev BG, Mandelshtam MY, Vasaitis R, Musolin DL (2017) The frontline of invasion: the current northern limit of the invasive range of emerald ash borer, Agrilus planipennis Fairmaire (Coleoptera: Buprestidae), in European Russia. Balt For 23: 309–315.
Silk P, Ryall K (2015) Semiochemistry and chemical ecology of the emerald ash borer Agrilus planipennis (Coleoptera: Buprestidae). Can Entomol 147: 277–289. https://doi.org/10.4039/tce.2014.58.
Silk PJ, Roscoe LE, Brophy M, Price J, Ryall KL (2018) Influence of light on sound production behaviors in the emerald ash borer, Agrilus planipennis. Entomol Exp Appl 166: 844–853. https://doi.org/10.1111/eea.12727.
Sobek S, Rajamohan A, Dillon D, Cumming RC, Sinclair BJ (2011) High temperature tolerance and thermal plasticity in emerald ash borer Agrilus planipennis. Agric For Entomol 13: 333–340. https://doi.org/10.1111/j.1461-9563.2011.00523.x.
Soldi E, Fuller E, Tiley AMM, Murchie AK, Hodkinson TR (2022) First report of the ash sawfly, Tomostethus nigritus, established on Fraxinus excelsior in the Republic of Ireland. Insects 13, article id 6. https://doi.org/10.3390/insects13010006.
Srei N, Lavallee R, Guertin C (2020) Horizontal transmission of the entomopathogenic fungal isolate INRS-242 of Beauveria bassiana (Hypocreales: Cordycipitaceae) in emerald ash borer, Agrilus planipennis (Coleoptera: Buprestidae). J Econ Entomol 113: 543–545. https://doi.org/10.1093/jee/toz256.
Stocks JJ, Metheringham CL, Plumb WJ, Lee SJ, Kelly LJ, Nichols RA, Buggs RJA (2019) Genomic basis of European ash tree resistance to ash dieback fungus. Nat Ecol Evol 3: 1686–1696. https://doi.org/10.1038/s41559-019-1036-6.
Straw NA, Williams DT, Kulinich O, Gninenko YI (2013) Distribution, impact and rate of spread of emerald ash borer Agrilus planipennis (Coleoptera: Buprestidae) in the Moscow region of Russia. Forestry 86: 515–522. https:///doi.org/10.1093/forestry/cpt031.
Sønstebø, JH, Adam Vivian-Smith A, Adamson K, Drenkhan R, Solheim, H, Hietala AM (2017) Genome-wide population diversity in Hymenoscyphus fraxineus points to an eastern 2 Russian origin of European Ash dieback. BioRxiv, article id 154492. https://doi.org/10.1101/154492.
Tanis SR, McCullough DG (2015) Host resistance of five fraxinus species to Agrilus planipennis (Coleoptera: Buprestidae) and effects of paclobutrazol and fertilization. Environ Entomol 44: 287–299. https://doi.org/10.1093/ee/nvu005.
Taylor RAJ, Bauer LS, Poland TM, Windell KN (2010) Flight performance of Agrilus planipennis (Coleoptera: Buprestidae) on a flight mill and in free flight. J Insect Behav 23: 128–148. https://doi.org/10.1007/s10905-010-9202-3.
Timmermann V, Børja I, Hietala AM, Kirisits T, Solheim H (2011) Ash dieback: pathogen spread and diurnal patterns of ascospore dispersal, with special emphasis on Norway. EPPO Bulletin 41: 14–20. https://doi.org/10.1111/j.1365-2338.2010.02429.x.
Ulrich K, Becker R, Behrendt U, Kube M, Ulrich A (2020) A comparative analysis of ash leaf-colonizing bacterial communities identifies putative antagonists of Hymenoscyphus fraxineus. Front Microbiol 11, article id 966. https://doi.org/10.3389/fmicb.2020.00966.
Ulyshen MD, Duan, JJ, Bauer LS (2010a) Interactions between Spathius agrili (Hymenoptera: Braconidae) and Tetrastichus planipennisi (Hymenoptera: Eulophidae), larval parasitoids of Agrilus planipennis (Coleoptera: Buprestidae). Biol Contr 52: 188–193. https://doi.org/10.1016/j.biocontrol.2009.10.017.
Ulyshen MD, Duan JJ, Bauer LS, Fraser I (2010b) Suitability and accessibility of immature Agrilus planipennis (Coleoptera: Buprestidae) stages to Tetrastichus planipennisi (Hymenoptera: Eulophidae). J Econ Entomol 103: 1080–1085. https:/doi.org/10.1603/EC10024.
Valenta V, Moser D, Kapeller S, Essl F (2017) A new forest pest in Europe: a review of Emerald ash borer (Agrilus planipennis) invasion. J Appl Entomol 141: 507–526. https://doi.org/10.1111/jen.12369.
Venier LA, Holmes SB (2010) A review of the interaction between forest birds and eastern spruce budworm. Environ Rev 18: 191–207. https://doi.org/10.1139/A10-009.
Verheyde F, Sioen G (2019) Outbreaks of Tomostethus nigritus (Fabricius, 1804) (Hymenoptera, Tenthredinidae) on Fraxinus angustifolia ‘Raywood’ in Belgium. J Hymenoptera Res 72: 67–81. https://doi.org/10.3897/jhr.72.38284.
Viiri H, Pouttu A, Lumme I, Mannerkoski I (2018) Tomostethus pistiäistuhot saarnilla. Julkaisussa: Nevalainen S, Nuorteva H, Pouttu A (toim) Metsätuhot vuonna 2017. Luonnonvara- ja biotalouden tutkimus 44/2018, s. 41−42. http://urn.fi/URN:ISBN:978-952-326-622-3.
Viiri H, Pouttu A, Lumme I (2019) Tomostethus nigritus -tuhot saarnilla jatkuivat. Julkaisussa: Nuorteva H (toim) Metsätuhot vuonna 2018. Luonnonvara- ja biotalouden tutkimus 85/2019, s. 52–54. http://urn.fi/URN:ISBN:978-952-326-878-4.
Viitasaari M, Paukkunen J (2010) Sahapistiäiset – Sawflies Hymenoptera: Symphyta. Julkaisussa: Rassi P, Hyvärinen E, Juslén A, Mannerkoski I (toim) Suomen lajien uhanalaisuus – Punainen kirja 2010, Ympäristöministeriö & Suomen ympäristökeskus, Helsinki, s. 511–518. http://hdl.handle.net/10138/299499.
Volkovitsh MG, Bienkowski AO, Orlova-Bienkowskaja MJ (2021) Emerald ash borer approaches the borders of the European Union and Kazakhstan and is confirmed to infest European ash. Forests 12, article id 691. https://doi.org/10.3390/f12060691.
Väre H, Kiuru H (2015) Suomen puut ja pensaat. 3. tarkistettu painos. Metsäkustannus Oy.
Wang XP, Bergman RD, Brashaw BK, Myers SW (2014) Heat treatment of firewood for emerald ash borer (Agrilus planipennis Fairmaire): case studies. J Forest 112: 361–370. https://doi.org/10.5849/jof.14-033.
Wang XY, Yang ZQ, Gould JR, Zhang YN, Liu GJ, Liu ES (2010) The biology and ecology of the emerald ash borer, Agrilus planipennis, in China. J Insect Sci 10, article id 128. https://doi.org/10.1673/031.010.12801.
Wei X, Wu Y, Reardon R, Sun TH, Lu M, Sun JH (2007) Biology and damage traits of emerald ash borer (Agrilus planipennis Fairmaire) in China. Insect Sci 14: 367–373. https://doi.org/10.1111/j.1744-7917.2007.00163.x.
Wessels-Berk B, Scholte EJ (2008) One beetle too many: the emerald ash-borer, Agrilus planipennis (Coleoptera: Buprestidae), threatens Fraxinus trees in Europe. Proc Neth Entomol Soc Meet 19: 165–168.
Wohlmuth A, Essl F, Heinze B (2018) Genetic analysis of inherited reduced susceptibility of Fraxinus excelsior L. seedlings in Austria to ash dieback. Forestry 91: 514–525. https://doi.org/10.1093/forestry/cpy012.
Zhao Y J, Hosoya T, Baral HO, Hosaka K, Kakishima M (2013) Hymenoscyphus pseudoalbidus, the correct name for Lambertella albida reported from Japan. Mycotaxon 122: 25–41. https://doi.org/10.5248/122.25.
Yang ZQ, Wang XY, Gould JR, Reardon RC, Zhang YN, Liu GJ, Liu ES (2010) Biology and behavior of Spathius agrili, a parasitoid of the emerald ash borer, Agrilus planipennis, in China. J Insect Sci 10, article id 30. https://doi.org/10.1673/031.010.3001.
133 viitettä.